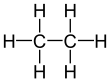
Etan
Etan, C2H6 formülüne sahip bir bileşiktir. Alkanların ikinci en küçük molekülü olan etan, normal sıcaklık ve basınçta kokusuz ve renksiz bir gazdır. Etan, doğalgazda metandan sonra en fazla bulunan ikinci gazdır.
| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Etan | |||
Dikarban | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| 1730716 | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| EC Numarası |
| ||
| 212 | |||
| MeSH | Ethane | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UN numarası | 1035 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | C2H6 | ||
| Molekül kütlesi | 30,07 g mol−1 | ||
| Görünüm | Renksiz gaz | ||
| Yoğunluk |
544.0 kg/m−3 (-88,5°C'de sıvı) | ||
| Erime noktası | 90.4 K | ||
| Kaynama noktası | 184.6 K | ||
| Çözünürlük (su içinde) | 56.8 mg L−1[2] | ||
| Buhar basıncı | 3.8453 MPa (21.1°C'de) | ||
Henry yasası
sabiti (kH) |
19 nmol Pa−1 kg−1 | ||
| Asitlik (pKa) | 50 | ||
| Baziklik (pKb) | -36 | ||
| Termokimya | |||
Isı sığası (C)
|
52.49 J K−1 mol−1 | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
−84 kJ mol−1 | ||
Standart yanma entalpisi (ΔcH⦵298)
|
−1561.0–−1560.4 kJ mol−1 | ||
| Tehlikeler | |||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | −135 | ||
| 472 | |||
| Patlama sınırları | 2.9–13% | ||
| Güvenlik bilgi formu (SDS) | inchem.org | ||
| Benzeyen bileşikler | |||
Benzeyen alkanlar
|
|||
Benzeyen bileşikler
|
|||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Tarihi
değiştirEtan molekülü yapay olarak ilk defa 1834 yılında Michael Faraday tarafından potasyum asetatın elektrolizi ile üretildi. Ancak Faraday bunun metan olduğunu düşünerek bunun üzerinde durmadı. 1847–1849 arasında Hermann Kolbe ve Edward Frankland, organik bileşikler üzerine yaptığı çalışmalar sırasında etanı yine elde etti, fakat bunu metil bir bileşik sandı. 1864 yılında bu hataları Carl Schorlemmer düzeltti.
Üretim
değiştirEtan üretilirken aşağıdaki aşamalar izlenmektedir:
Kaynakça
değiştir- ^ "Ethane – Compound Summary". PubChem Compound. ABD: National Center for Biotechnology Information. 16 Eylül 2004. 4 Kasım 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Aralık 2011.
- ^ Lide, D. R., (Ed.) (2005). CRC Handbook of Chemistry and Physics (86. bas.). Boca Raton (FL): CRC Press. s. 8.88. ISBN 0-8493-0486-5.