Gliserin
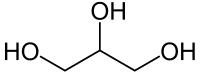
Gliserin, diğer adı gliserol olan, sıvı hâlde bulunan polar organik bir trihidroksi alkoldür. Hafifçe tatlı, zehirli olmayan bir sıvıdır. Su ve etanol ile karışır; asetonda çözünür.
| |

| |
| Adlandırmalar | |
|---|---|
Gliserin | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.000.263 |
| E numaraları | E422 (yoğunlaştırıcılar, ...) |
PubChem CID
|
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | C3H8O3 |
| Molekül kütlesi | 92,09 g·mol−1 |
| Görünüm | Renksiz, viskoz sıvı |
| Yoğunluk | 1,26 g/cm3 |
| Erime noktası | 18 °C |
| Kaynama noktası | 290 °C[1] |
| Çözünürlük (su içinde) | Suda ve Etanol'de karışır |
| Tehlikeler | |
| Güvenlik bilgi formu (SDS) | ICSC 1507 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Tıbbî gliserin diyabet hastalığında tatlandırıcı olarak kullanılır, E numarası E442'dir. Dıştan deriye uygulanan merhemlerle; kozmetik sektöründen ruj, eyeliner gibi ürünlerde kullanılır. Plastik sanayinde ikincil plastikleştirici olarak kullanılır. Trinitrogliserin ve nitrik asitle birleştirilerek dinamit yapılabilir. Sadece nitrik asit ile birleştirildiğinde ise çok güçlü bir patlayıcı olan Nitrogliserin yapımında kullanılır.
Gliserin, 1,2,3-Propantriolün yaygın adıdır. Şurup kıvamındaki bu renksiz sıvı, suda çözülebilmektedir. Hayvansal ve bitkisel yağ maddelerinin içinde bulunur, ayrıca petrolden ve propandan da sentezlenebilmektedir. Canlılarda yağ sentezinde yağ asitleriyle esterleşerek trigliseritleri yani yağı oluşturur. Deriye uygulandığında lipitlerin yapısına katılır. Tıpta yumuşatıcı olarak, endüstride sabun ve özel dokumaların yapımında kullanılır. Yağlı maddelerin sabunlaştırılmasıyla elde edilen gliserol, bir trihidrik alkoldür; yani her biri farklı bir karbon atomuna bağlı üç hidroksil grubu (OH) içerir. Gliserolün diğer kullanımları arasında patlayıcı madde yapımı, sanayi çözücüleri üretimi sayılabilir. Aynı zamanda gliserol gıdalarda aw (su aktivitesi) değerinin düşürülmesine yardımcı olur.
Kaynakça
değiştir- ^ Lide, D. R., ed. (1994). CRC Handbook of Data on Organic Compounds (3rd ed.). Boca Raton, FL: CRC Press. p. 4386.
| Biyokimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |