Hidrojen florür
Hidrojen florür, formülü HF olan bir kimyasal bileşiktir. Bu renksiz gaz genellikle, hidroflorik asit gibi sulu çözelti formunda bulunur ve florun başlıca sanayi kaynağıdır. İlaç ve polimer (örneğin teflon) endüstrisinde kullanılan önemli bileşiklerin öncüsüdür. HF petrokimya endüstrisinde yaygın olarak kullanılır ve birçok süperasitin bir bileşenidir. Hidrojen florür oda sıcaklığının hemen altında kaynar. Diğer hidrojen halojenürler ise çok daha düşük sıcaklıklarda kaynarlar. Diğer hidrojen halidlerden farklı olarak, HF havadan daha hafiftir ve gözenekli maddelerde oldukça çabuk şekilde yayılır.

| |
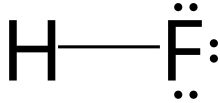
| |

| |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.759 |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Kimyasal formül | HF |
| Molekül kütlesi | 20,01 g mol−1 |
| Görünüm | Renksiz gaz veya renksiz sıvı (19,5 °C'nin altında) |
| Yoğunluk | 1,15 g/L, gaz (25 °C) 0,99 g/mL, sıvı (19,5 °C) |
| Erime noktası | −83,6 °C (−118,5 °F; 189,6 K) |
| Kaynama noktası | 19,5 °C (67,1 °F; 292,6 K) |
| Çözünürlük (su içinde) | Karışabilir |
| Buhar basıncı | 783 mmHg (20°C) |
| Asitlik (pKa) | 3.17[1][2] |
| Tehlikeler | |
| NFPA 704 (yangın karosu) |
|
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 3 ppm |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Hidrojen florür; hidroflorik asit formunda canlı doku ile temas ettiğinde aşındırıcı, delici ve son derece tehlikeli bir gazdır. Gaz ayrıca korneanın hızlı yıkımı ile körlüğe neden olabilir.
Carl Wilhelm Scheele 1771'de büyük miktarlarda hidroflorik asit hazırlamıştır. Fransız kimyacı Edmond Fremy (1814-1894) ise, flor izole etmeye çalışırken anhidröz hidrojen florürü keşfetmiştir. Bununla birlikte hidroflorik asit bu araştırmacılardan önce de cam sanayinde bilinmekteydi.
Kaynakça
değiştir- ^ "pKa's of Inorganic and Oxo-Acids" (PDF). Harvard. 11 Ağustos 2015 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 9 Eylül 2013.
- ^ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432-433.
Dış bağlantılar
değiştir- "ATSDR – MMG: Hydrogen Fluoride". Retrieved May 14, 2006
- CDC - NIOSH Pocket Guide to Chemical Hazards26 Temmuz 2014 tarihinde Wayback Machine sitesinde arşivlendi.
