Enzim
Enzimler, kataliz yapan (yani kimyasal tepkimelerin hızını artıran) biyomoleküllerdir.[1][2] Neredeyse tüm enzimler protein yapılıdır. Enzim tepkimelerinde, bu sürece giren moleküllere substrat denir ve enzim bunları farklı moleküllere, ürünlere dönüştürür. Bir canlı hücredeki tepkimelerin neredeyse tamamı yeterince hızlı olabilmek için enzimlere gerek duyar. Enzimler substratları için son derece seçici oldukları için ve pek çok olası tepkimeden sadece birkaçını hızlandırdıklarından dolayı, bir hücredeki enzimlerin kümesi o hücrede hangi metabolik yolakların bulunduğunu belirler.
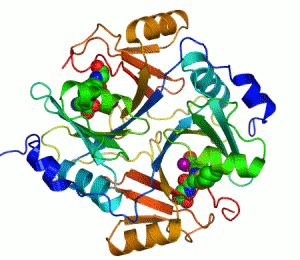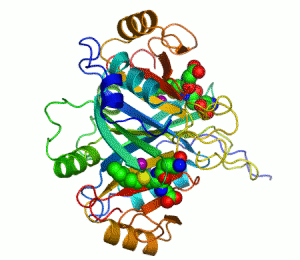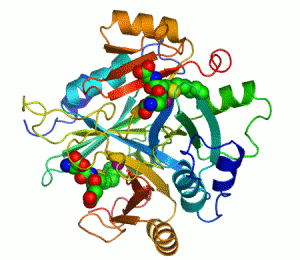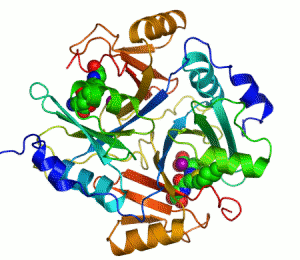
Her katalizör gibi enzimler de bir tepkimenin aktivasyon enerjisini (Ea veya ΔG‡) azaltarak çalışır ve böylece tepkime hızını çarpıcı şekilde artırır. Çoğu enzim tepkimesi, ona karşılık gelen ve katalizlenmeyen tepkimeden milyonlarca kere daha hızlıdır. Diğer katalizörler gibi enzimler de katalizledikleri tepkime sonucunda tükenmez ve bu tepkimelerin dengesini değiştirmez. Ancak, diğer çoğu katalizörden farklı olarak enzimler çok daha özgüldür (spesifiktir). Enzimlerin 4000'den fazla biyokimyasal tepkimeyi katalizlediği bilinmektedir.[3]
Enzimlerin büyük çoğunluğu protein olmakla beraber, ribozim adlı bazı RNA molekülleri de tepkimeleri katalizler, bunun en iyi bilinen örneği ribozomu oluşturan bazı RNA'lardır.[4][5]
Enzimlerin etkinliği başka moleküller tarafından etkilenebilir. İnhibitörler enzim aktivitesini azaltan moleküllerdir, aktivatörler ise enzim aktivitesi artıran moleküllerdir. Etkinlik ayrıca sıcaklık, kimyasal ortam (örneğin pH) ve substrat konsantrasyonu tarafından etkilenir. Bazı enzimler endüstriyel amaçla kullanılırlar, örneğin antibiyotik sentezinde. Ayrıca bazı ev ürünlerinde biyokimyasal tepkimeleri hızlandırmak için enzim kullanılır (örneğin, çamaşır tozunda bulunan enzimler lekelerdeki protein ve yağları parçalar).
Etimoloji ve tarih
değiştir1700'lerin sonlarında mide salgıları tarafından etin sindirildiği, tükürük ve bazı bitki özütlerinin nişastayı şekerlere dönüştürdüğü biliniyordu.[6] Ancak, bunun hangi mekanizmayla olduğu bilinmiyordu.[7]
19. yüzyılda, Louis Pasteur, maya tarafından şekerin alkole dönüşmesini (fermantasyonu) araştırırken, fermantasyonun maya hücrelerinde bulunan bir canlı güç tarafından meydana geldiği sonucuna vardı. "Ferment" diye adlandırdığı bu etmenler sadece canlılarda işlev gördüğü düşünülüyordu. Pasteur, "alkol fermantasyonu yaşam ve maya hücrelerinin organizasyonu ile bağıntılıdır, hücrelerin ölüm ve çürümesiyle değil" diye yazmıştır.[8] 1878'de Alman fizyolog Wilhelm Kühne (1837-1900) ilk defa wikt:enzim terimini kullandı; sözcük Yunanca ἔνζυμον'den ("maya içinde") türetilmişti, söz konusu süreci betimlemek için. Daha sonraları enzim sözcüğü canlı olmayan bileşikler (örneğin pepsin) için kullanılmış, canlılar tarafından üretilen kimyasal aktiviteler için de "ferment" sözcüğü kullanılmaya başlanmıştır.
1897'de Eduard Buchner içinde canlı hücre bulunmayan maya özütünün (ekstresinin) şekeri fermante etme yeteneği olduğunu gösterdi.[9] Sükroz şekerinin fermantasyonuna yol açan enzime "zimnaz" adını verdi.[10] 1907'de "biyokimya araştırmaları ve hücresiz fermantasyonu keşfi için" Nobel Kimya Ödülünü kazandı. Buchner'in örneği izlenerek enzim adları katalizledikleri tepkimelere göre adlandırılır. Tipik olarak substratın veya reaksiyon tipinin adının sonuna -az eklenir. Örneğin, laktaz, laktozu parçalayan enzimdir, DNA polimeraz, DNA polimerleri oluşturan enzimdir.
Enzimlerin hücre dışında çalıştığının gösterilmesinin ardından gelen aşama, bunların biyokimyasal niteliğinin anlaşılmasıydı. İlk araştırmacılar çoğu enzim etkinliğinin proteinlerle ilişkili olduğunu kaydetmiş, ama bazı bilimciler (örneğin Nobel ödüllü Richard Willstätter) proteinlerin sadece gerçek enzimlerin birer taşıyıcısı olduğunu ve proteinlerin kendi başlarına kataliz yapmaktan aciz olduklarını iddia etmiştir. Ancak, 1926'da James B. Sumner, üreaz enziminin saf bir protein olduğunu gösterdi ve onu kristalleştirdi; 1937'de Sumner aynı işi katalaz enzimi için yaptı. Saf proteinlerin enzim oldukları kesin olarak Northrop ve Stanley tarafından, bunların sindirim enzimleri tripsin ve kimotripsin üzerinde yaptıkları çalışma sonucunda gösterildi. Bu üç bilimci 1946 Nobel Kimya Ödülünü kazandılar.[11]
Enzimlerin kristalleştirilebildiğinin gösterilmesi, onların yapılarını X ışını kristalografisi ile çözülmesini mümkün kıldı. Bu ilk defa David Chilton Phillips önderliğinde bir grup tarafından lizozim için başarıldı ve 1965'te yayımlandı[12] (lizozim göz yaşında, tükürükte ve yumurta beyazında bulunan ve bakterilerin hücre duvarını sindiren bir enzimdir). Lizozimin yüksek çözülümlü yapısı yapısal biyoloji sahasının ve enzimlerin nasıl çalıştığının atomik düzeyde anlaşılmasının başlangıcı olmuştur.
Adlandırma ve terminoloji
değiştirBir enzimin adı çoklukla substratı veya katalizlediği reaksiyonun adından türetilir, sözcüğün sonuna -az eki getirilerek. Bunun örnekleri laktaz, alkol dehidrojenaz ve DNA polimerazdır. Bu adlandırma yöntemi ile, aynı tepkimeyi katalizleyen farklı enzimler aynı temel ada sahip olabilir, bunlara izoenzim denir. İzoenzimlerin amino asit dizileri birbirinden farklı olur ve optimal pH'leri, kinetik özellikleri ve immünolojik özellikleri ile ayırt edilebilirler. Ayrıca, yapay şartlar altında bir enzimin katalizlediği tepkime, fizyolojik şartlarda katalizlediğiyle aynı olmayabilir. Bu yüzden bazen aynı enzimin iki farklı adla tanımlandığı olur. Örneğin, endüstride glukozu fruktoz tatlandırıcısına dönüştürmek için kullanılan glukoz izomeraz, hücre ortamında (in vivo) ksiloz izomeraz olarak adlandırılır.
Uluslararası Biyokimya ve Moleküler Biyoloji Birliği, EC numaraları denen, enzimler için bir adlandırma sistemi geliştirmiştir; her enzim başında da "EC" olan ve dört sayıdan oluşan bir dizi ile betimlenir. İlk sayı enzimleri mekanizmalarına göre genel olarak sınıflandırır.[13]
Üst düzey sınıflandırma şöyledir:
- EC 1 Oksidoredüktazlar: yükseltgenme/indirgenme (redoks) tepkimelerini katalizler
- EC 2 Transferazlar: Fonksiyonel grupların (örn. bir metil veya fosfat grubunun) transferini katalizler
- EC 3 Hidrolazlar: çeşitli bağların hidrolizini katalizler
- EC 4 Liyazlar: Hidroliz ve yükseltgenme harici yollar ile çeşitli bağları keser
- EC 5 İzomerazlar: Tekil bir molekülde izomerizasyon değişikliklerini katalizler
- EC 6 Ligazlar: İki molekülü kovalent bağlarla birleştirir.
Yapılar ve mekanizmalar
değiştirEnzimler genelde küresel proteinlerdir, büyüklük olarak 62 amino asitten (4-oksalokrotonat totomeraz'ın monomeri[14]) 2500 amino asitten fazlasına (hayvan yağ asit sentaz[15]) kadar uzanırlar. Az sayıda RNA-temelli biyolojik katalizörler de mevcuttur, bunların en yaygın olanı ribozomdur, bunlara RNA-enzim ya da ribozim denir. Enzimlerin etkinliği onların üç boyutlu yapısı tarafından belirlenir.[16] Çoğu enzim etki ettikleri substratlardan çok daha büyüktür ve enzimin sadece ufak bir bölümü (3-4 amino asit kalıntısı) doğrudan kataliz ile doğrudan ilişkilidir.[17] Bu katalitik amino asit kalıntıların bulunduğu, substrata bağlanan ve tepkimeyi yürüten bölge aktif merkez (veya aktif bölge) olarak adlandırılır. Enzimlerde ayrıca kataliz için gerekli olan kofaktörlerin bağlandığı konumlar da mevcuttur. Bazı enzimlerde ayrıca katalizlenen tepkimenin endirekt substrat veya ürünleri olan küçük moleküllerin bağlandığı başka yerler vardır. Bu bağlanma enzimin aktivitesini artırabilir veya azaltabilir, bu da geri beslemeli bir düzenleme yoludur.
Çoğu protein gibi enzimler de uzun amino asit zincirlerinden oluşur, bunlar katlanır ve üç boyutlu bir yapı oluşturur. Her amino asit dizisi, kendine has özellikleri olan özgül bir yapı oluşturur. Tek başına protein zincirleri bazen gruplanarak protein kompleksleri oluşturabilir. Çoğu enzim ısı veya bazı kimyasal etmenlerle denatüre olur, yani proteinin üç boyutlu yapısının bozulması sonucu katlanmış hali açılır ve inaktive olur. Enzime bağlı olarak denatürasyon tersinir olabilir veya olmayabilir.
Özgüllük
değiştirEnzimler genelde hangi tepkimeleri katalizledikleri ve bu tepkimelerdeki substratlar konusunda çok özgüldürler. Enzim ve substratlarının birbirini tamamlayıcı şekil, yük ve hidrofilik/hidrofobik özellikleri bu özgüllüğü meydana getirir. Enzimler ayrıca steroizomerik, yönsel ve kimyasal özgüllük de gösterebilirler.[18]
En yüksek seviyede özgüllük ve doğruluk gösteren enzimler genomun kopyalanması ve ifadesi ile ilişkilidir. Bu enzimlerin "prova okuma" mekanizmaları vardır. DNA polimeraz gibi bir enzim, ilk aşamada bir reaksiyonu katalizler, ikinci aşamada da ürünün doğruluğunu kontrol eder.[19] Bu iki adımlı süreç sayesinde yüksek sadakatli polimerazlarda ortalama hata oranı 100 milyon reaksiyonda 1'den az olur.[20] Benzer prova-okuma mekanizmaları RNA polimeraz,[21] aminoasil tRNA sentetaz[22] ve ribozomlarda[23] da vardır.
İkincil metabolit üreten bazı enzimler ayrım gözetmediği söylenir, çünkü göreceli olarak geniş bir substrat grubuna etki edebilirler. Substrat özgüllüğündeki bu genişlik sayesinde yeni metabolik yolların evrimleşebildiği öne sürülmüştür.[24]
"Anahtar kilit" modeli
değiştirEnzimler hangi tepkimeyi katalizledikleri ve bu tepkimeye hangi substratın girdiğine çok büyük bir özgüllük gösterirler. 1894'te Emil Fischer bunun nedeninin, enzim ve substratının birbirine tam uyan tamamlayıcı geometrik şekilleri olmasından dolayı olduğunu öne sürmüştür.[25] Bu fikre sıkça "anahtar kilit" modeli olarak değinilir. Bu model enzim özgüllüğünü açıklasa da geçiş halinin enzim tarafından stabilizasyonunu açıklamaz. "Anahtar ve kilit" modeli artık yetersiz sayılmaktadır, "indüklenmiş uyum" (İng. induced fit) modeli hâlen en yaygın kabul gören enzim-substrat-koenzim şeklidir.
İndüklenmiş uyum modeli
değiştir1958'de Daniel Koshland anahtar ve kilit modelinin bir modifikasyonunu öne sürdü: enzimler göreli olarak esnek yapılar olduklarına göre, substrat enzimle etkileşirken aktif merkezin şekli sürekli olarak substrat tarafından değiştirilmektedir.[26] Bunun sonucu olarak, substrat sadece hareketsiz bir aktif merkeze bağlanmaz, aktif merkezi oluşturan amino asit yan zincirleri biçim alarak enzimin katalitik işlevini yerine getirmesini sağlarlar. Bazı durumlarda, örneğin glikozidazlarda, substrat molekül de aktif merkeze girerken şeklini biraz değiştirir.[27] Substrat tamamen bağlanana kadar aktif merkez şeklini değişitirir, o noktada en son şekil ve yükü belirlenmiş olur.[28]
Mekanizmalar
değiştirEnzimler birkaç farklı yolla çalışırlar, bunların hepsi aktivasyon enerjisini (ΔG‡) azaltır:[29]
- Geçiş durumunu stabilize olduğu bir ortam yaratarak (Örneğin, substratın şeklini zorlayarak - substrat/ürün molekülünün geçiş hâl biçimine bağlanarak enzim bağlı substrat(ları) çarpıtır ve geçişin tamamlanması için gerekli enerji miktarını azaltır.)
- Geçiş hâlinin enerjisini azaltarak, örneğin geçiş hâlindekinin tersi bir yük dağılımına sahip bir ortam yaratarak.
- Alternatif bir yol sağlayarak. Örneğin, substratla geçici olarak tepkiyerek bir ES kompleksi oluşturarak.
- Substratları tepkimeleri için onları doğru yönde bir araya getirerek tepkime entropi değişikliğini azaltarak. ΔH‡ değerine tek başına bakmak bu etkiyi göz ardı eder.
İlginç bir şekilde, bu entropik etki, temel halin destabilizasyonu ile ilişkilidir,[30] ve katalize olan katkısı göreli olarak düşüktür.[31]
Geçiş hali stabilizasyonu
değiştirAktivasyon enerjisi azalmasını anlamak için onun geçiş halinin katalizlenmemiş tepkimenin geçiş haline kıyasla enzim tarafından nasıl stabilize edildiğinin bilmek gerekir. Büyük bir stabilizasyon elde etmenin en etkili yolu elektrostatik etkiler kullanmaktır, özellikle geçiş halinin yük dağılımına doğru yönlenmiş, nispeten sabit polar bir ortam oluşturarak.[32] Suda cereyan eden katalizlenmeyen tepkimede böylesi bir ortam yoktur.
Dinamik ve işlevler
değiştirYakın zamanlarda yapılan araştırmalar sonucunda enzimlerin iç dinamikleri ile kataliz mekanizması arasındaki ilişki daha iyi anlaşılmaya başlamıştır.[33][34][35] Bir enzimin iç dinamikleri onun iç kısımlarının (örneğin bir grup amino asit, bir ilmik bölgesi, bir alfa sarmal, komşu beta yapraklar ve hatta bütün bir bölge) hareketleridir. Bu hareketler femtosaniyelerden saniyelere kadar uzanan zaman ölçeklerinde cereyena edebilir. Bir enzimin yapısının içinde yer alan protein kalıntılarının oluşturduğu ağlar, hareketleri ile katalize katkıda bulunabilirler.[36][37][38][39] Protein hareketleri pek çok enzim için çok önemlidir, ama küçük ve hızlı titreşimlerin mi, büyük ve yavaş hareketlerin mi daha önemli olduğu tepkimenin tipine bağlıdır. Ancak, bu hareketler substrat ve ürülerin bağlanma ve salınmaları için önemli olsalar da, protein hareketlerinin enzimatik tepkimelerdeki kimyasal adımları hızlandırdığı belli değildir.[40] Bu bulgular alosterik etkilerin anlaşılmasında ve yeni ilaçların keşfinde önemli uzantıları vardır.
Alosterik modülasyon
değiştirAlosterik enzimler, effektörlerine bağlanmaya cevaben yapılarını değiştirirler. Eğer effektör molekül doğrudan enzimdeki bağlanma yerlerinden birine bağlanırak katalitik aktiviteye etki ederse modülasyon doğrudan olur, allosterik enzimle etkileşen başka protein veya protein alt birimlerine bağlanıyorsa modülasyon dolaylı olur.
Kofaktörler ve koenzimler
değiştirKofaktörler
değiştirBazı enzimler etkinliklerini göstermek için ek bir bileşiğe gerek duymazlar bunlara basit enzim denir. Ancak bileşik enzim denen bazıları aktiviteleri için, kofaktör denen, protein olmayan moleküllere gerek duyarlar.[41] Kofaktörler inorganik (örneğin metal iyonları ve demir-kükürt kümeleri veya Organik bileşikler (örneğin, flavin ve hem). Organik kofaktörler ya prostetik gruptur, bunlar enzime sıkıca bağlıdır ya da koenzimdir, bunlar tepkime sırasında enzimin aktif merkezinden salınırlar. Koenzimler arasında NADH, NADPH ve ATP sayılabilir. Bu moleküller enzimler arasında kimyasal gruplar taşımaya yararlar.[42]
Kofaktör içeren bir enzimlere bir örnek karbonik anhidrazdır, yukarıdaki şeritli şekilde aktif merkezinin parçası olan çinko kofaktörle birlikte gösterilmiştir.[43] Bu sıkıca bağlı moleküller genelde aktif merkezde bulunur ve katalizle ilişkilidir. Örneğin flavin ve hem kofaktörleri çoğunlukla redoks tepkimelerinde yer alırlar.
Kofaktör gerektiren ama bunlara bağlı olmayan enzimlere apoenzim veya apoprotein denir. Kofaktörüyle beraber olan apoenzime holoenzim denir, bu o enzimin aktif hâlidir. Çoğu kofaktör bir enzime kovalent bağlı değildir ama ona sıkıca bağlıdır. Buna karşın, organik prostetik gruplar kovalent bağlı olabilirler (örneğin pirüvat dehidrojenaz enzimindeki tiamin pirofosfat). Holoenzim terimi birden çok protein altbirimden oluşmuş enzimler için de kullanılabilir; örneğin DNA polimeraz'larda holoenzim, aktivite için gerekli olan tüm altbirimleri içeren kompleksin tamamıdır.
Koenzimler
değiştirKoenzimler kimyasal grupları bir enzimden öbürüne taşıyan küçük organik moleküllerdir.[44] Bu bileşiklerden bazıları vitamindir; riboflavin, tiamin ve folik asit gibi. Vitaminler vücut tarafından üretilemezler ve besin yoluyla elde edilmelidirler. Taşınan kimyasal gruplara örnek olarak NAD tarafından taşınan hidrür iyonu (H-), koenzim A tarafından taşınan asetil grubu, folik asit tarafından taşınan formil, metenil veya metil grupları ve S-adenozilmetiyonin tarafından taşınan metil grubu gösterilebilir.
Koenzimler enzim etkisiyle kimyasal olarak değiştikleri için, koenzimlerin farklı enzimlere ortak özel bir substrat sınıfı veya ikinci bir substrat olarak değerlendirilmesi yararlıdır. Örneğin NADH koenzimini kullanan yaklaşık 700 enzim bilinmektedir.[45]
Koenzimler genelde kullanıldıktan sonra yenilenirler ve hücredeki konsantrasyonları sabit kalır: örneğin NADPH pentoz fosfat yolu ile yeniden oluşturulur, S-adenozilmetyonin de metiyonin adenoziltransferaz kullanılır.
Termodinamik
değiştirBütün katalizörler gibi enzimler de tepkimenin kimyasal dengesini değiştirmezler. Genelde, bir enzimin mevcudiyeti durumunda tepkimenin yönü, enzimin yokluğundaki yönün aynıdır, ama tepkime daha hızlı gider. Ancak, enzimin yokluğunda, başka olası katalizlenmeyen, "spontan" tepkimeler farklı ürünler meydana getirebilir, çünkü o şartlar altında diğer ürünler daha hızlı oluşabilir.
Buna ilaveten, enzimler iki veya daha fazla tepkimeyi birleştirebilir, öyle ki termodinamik açıdan olumlu bir tepkime, olumsuz bir tepkimeyi "götürebilir". Örneğin, ATP'nin hidrolizi sıkça başka kimyasal tepkimeleri yürütmeye yarar.
Enzimler ileri ve geri tepkimeyi eşit derecede katalizler. Dengeyi değil, ona ulaşma hızını değiştirirler. Örneğin, karbonik anhidraz, substratların konsantrasyonuna bağlı olarak tepkimesini her iki yönde de katalizleyebilir.
- (dokularda; yüksek CO2 konsantrasyonu)
- (akciğerlerde; düşük CO2 konsantrasyonu)
Buna rağmen, eğer denge taraflardan birine çok yakınsa, yani tepkime eksergonik ise, tepkime pratik anlamda tersinmezdir. Bu durumlarda enzim tepkimeyi sadece termodinamik olarak izin verilen yönde katalizler.
Kinetik
değiştirEnzim kinetiği, enzimlerin substratlarına bağlanmasını ve onları ürüne dönüştürmesini araştıran bilim dalıdır. Kinetik analizlerde kullanılan hız verileri enzim ölçümlerinden elde edilir.
1902'de Victor Henri[46] enzim kinetiğine dair nitel bir teori önerdi ama hidrojen iyonu konsantrasyonunu önemi daha bilinmediğinden deneysel verileri yararlı değildi. 1909'da Peter Lauritz Sørensen logaritmik pH ölçeğini tanımlayıp tamponlama kavramını keşfedince[47] alman kimyacı Leonor Michaelis ve onun kanadalı postdoku Maud Leonora Menten Henri'nin deneylerini tekrarladılar ve onun denklemlerini teyid ettiler. Henri-Michaelis-Menten kinetiği olarak değinilen bu denklemler Michaelis-Menten kinetiği olarak da bilinir.[48] Bu çalışma G. E. Briggs ve J. B. S. Haldane tarafından daha da geliştirilmiş, bunların geliştirdiği kinetik denklemler günümüzde hâlâ yaygın olarak kullanılmaktadır.[49]
Henri'nin ana katkısı enzim tepkimelerini iki aşamalı olarak düşünmek olmuştur. Birinci aşamada substrat enzimi tersinir olarak bağlanıp enzim-substrat kompleksini oluşturur. Bu bazen Michaelis kompleksi olarak adlandırılır. Enzim sonra tepkimenin kimyasal adımını katalizler ve ürünü salar.
Enzimlerin saniyede katalizlediği tepkime sayısı birkaç milyonu bulabilir. Örneğin, orotidin 5'-fosfat dekarbosilaz tarafından katalizlenen tepkime, enzim olmadığında substratının yarısını 78 milyon yılda tüketir. Ama dekarboksilaz eklendiğinde aynı süreç 25 milisaniye tutar.[50] Enzim hızları solüsyon şartlarına ve substrat konsantrasyonuna bağlıdır. Proteini denatüre eden şartlar, yüksek sıcaklık, aşırı pH veya tuz konsantrasyonu gibi, enzim aktivitesini ortadan kaldırır, substrat konsantrasyonunu artırmak ise aktiviteyi artırır. Bir enzimatik tepkimenin en yüksek hızını bulmak için, substrat konsantrasyonu artırılır, sabit bir ürün oluşum hızına varılana kadar. Bu, sağdaki doyma eğrisinde görülebilir. Doyma olmasının nedeni, substrat konsantrasyonu arttıkça, gittikçe artan sayıda enzim molekülünün substrata bağlı ES biçimine dönüşmesidir. Enzimin maksimum hızında (Vmax), tüm enzim aktif merkezleri substrat tarafından bağlı durumdadır ve ES kompleksinin miktarı toplam enzim miktarına eşittir. Ancak, Vmax enzimlerin kinetik sabitlerinden sadece biridir. Belli bir tepkime hızı için gereken substrat miktarı da önemlidir. Enzimin maksimum hızının yarısına ulaşması için gereken substrat konsantrasyonudur, Michaelis-Menten sabiti (Km) olarak tanımlanır. Her enzimin belli bir substrat için karakteristik bir Km değeri vardır, bu değer substratın enzime ne derece sıkıca bağlandığını gösterir. Bir diğer yararlı sabit sayı kcat'dır, bu bir saniyede aktif merkezde kaç substrat molekülünün değişime uğradığının sayısıdır.
Bir enzimin verimliliği kcat/Km olarak ifade edilebilir. Bu aynı zamanda özgüllük sabiti olarak adlandırılır ve tepkimenin tüm adımlarının hız sabitlerini içerir. Özgüllük sabiti hem affinite (bağlanma eğilimi), hem de katalitik yeteneği içerdiği için farklı enzimleri birbiriyle kıyaslamakta veya aynı enzimi farklı substratlar için kıyaslamakta yararlıdır. Özgüllük sabitinin teorik maksimumu difuzyon sınırıdır ve yaklaşık 108 ila 109 (M−1 s−1) arasındadır. Bu noktada enzimle substratın her çarpışması katalizle sonuçlanır ve ürün oluşumunun hızı artık tepkime hızıyla değil, moleküllerin difüzyon hızıyla sınırlanır. Bu özelliğe sahip enzimler "katalitik olarak mükemmel" veya "kinetik olarak mükemmel" olarak tanımlanırlar. Bu enzimlere örnek olarak trioz-fosfat izomeraz, karbonik anhidraz, asetilkolinesteraz, katalaz, fumaraz, β-laktamaz, and superoksit dismutaz gösterilebilir.
Michaelis-Menten kinetiği "kütle etkisi kanunu"na dayanır, bu serbest difüzyon ve rassal çarpışmalardan kaynaklanır. Ancak çoğu biyokimyasal ve hücresel süreç bu şartlara uymaz, çünkü ya makromoleküler kalabalık vardır, ya enzim/substrat/ürünün faz-ayrışması vardır ya da moleküllerin hareketi bir veya iki boyuta sınırlanmıştır.[51] Bu durumlarda, Michelis-Menten kinetiğinin fraktal boyutlu olarak uygulnaması gerekebilir.[52][53][54][55]
Bazı enzimler difüzyon hızından çok daha yüksek hızlarda çalışırlar. Bu olguyu açıklamak için birkaç mekanizma öne sürülmüştür. Bazı proteinler katalizi hızlandırmak için dipol elektrik alanlar kullanır, bu sayede substratlarını çeker ve onların doğru yönlenmesini sağlarlar. Başka modeller kuantum-mekanik tünelleme açıklamaları getirirler, bu modellere göre, bir proton veya elektron, tünelleme yoluyla aktivasyon bariyerinin içinden geçer. Triptamin oksidasyonunda protonlar için kuantum tünellemesi gözlemlenmiştir.[56] Proton tünellemesinin katalize ne kadar katkıda bulunduğu tartışmalıdır.[57][58] Tünelleme modeline göre enzim katalizinde aktivasyon enerji bariyerini aşmak için onun "üstünden" geçmek şart değildir, "içinden" de geçilebilir.
İnhibisyon
değiştirEnzim tepkime hızları çeşitli enzim inhibitör tipleri tarafından azaltılabilir. Bu etkiye inhibisyon (veya engelleme) denir.
- Yarışmalı inhibisyon
Yarışmalı inhibisyon veya yarışmalı engellemede (İng. competitive competition), inhibitör ve substrat enzim için yarışırlar (yani, aynı anda ikisi birden bağlanamaz). Yarışmalı inhibitörler genelde enzimin asıl substratına benzer. Örneğin, metotraksat, dihidrofolat redüktaz enziminin bir yarışmalı inhibitörüdür (bu enzim dihidrofolat'ın tetrahidrofolat'a indirgenmesini katalizler). Aşağıda sağdaki şekilde bu inhibitör ve folik asitin yapılarındaki benzerlik görülebilir. İnhibitörün bağlandığı yerin substrat bağlanma yeri olması (bazı metinlerde öyle belirtilmesine rağmen) şart değildir, eğer inhibitörün bağlanması enzimin biçimini değiştirip substratın bağlanmasına engel olursa ve kezâ tersi de olabiliyorsa, bu inhibisyon da yarışmalıdır. Yarışmalı inhibisyonda maksimal tepkime hızı değişmez, ama belli bir hıza ulaşabilmek için daha yüksek substrat konsantrasyonu gerekir, dolayısıyla görünür Km artar.
- Sınırlı yarışmalı inhibisyon
Sınırlı yarışmalı inhibisyon veya yarı-yarışmalı inhibisyonda (İng. noncompetitive competition), inhibitör serbest enzime değil, ancak ES-kompleksine bağlanabilir. Oluşan EIS-kompleksi enzimatik bakımdan inaktiftir. Bu tür inhibisyona ender rastlanır ama çokbirimli (multimerik) enzimlerde olabilir.
- Yarışmasız inhbisyon
Yarışmasız inhbisyon veya yarışma dışı engellemede (İng. uncompetitive competition), inhibitör enzim ve substratla aynı zamanda bağlanabilirler, yani bu tanım icabı, aktif merkeze hiçbir zaman bağlanmazlar. Hem EI hem de EIS kompleksleri enzimatik bakımdan inaktiftir. Yarışmalı inhibisyondakinden farklı olarak, substrat konsantrasyonu artırılarak inhibitörün enzime bağlanmasını azaltmak mümkün değildir, bu yüzden görünür Vmax değişir. Ama substrat enzime hâlâ bağlanabildiği için Km aynı kalır.
- Karışık inhibisyon
Bu tür inhibisyon sınırlı yarışmalı olana benzer, ama EIS-kompleksinde kısmî enzim aktivitesi vardır.
Çoğu canlıda inhibitörler geri besleme mekanizmasının parçası olarak etkirler. Eğer bir enzim bir bileşikten çok fazla miktarda üretirse bu bileşik, kendizini üreten metabolik yolun başında yer alan diğer bir enzime inhibitör olarak etki edebilir. Böylece, miktarı yeterli seviyede olunca bu bileşik oluşumu için gerekli olan substratın üretimini azaltır veya durdurur. Bu bir negatif geri besleme şeklidir. Bu tür düzenlemeye tâbi olan enzimler genelde multimerikdir (çok altbirimlidir) ve düzenleyici bileşikler için allosterik bağlanma konumlarına sahiptirler. Substrat/hız eğrileri hiperbolik değil sigmoidaldır (S-şekillidir).
Tersinmez İnhibisyon
Bu tür inhibisyon da enzimle inhibitör tepkimeye uğrar ve protein ile kovalent bir bağ meydana getirir. Meydana gelen inaktivasyon tersinmez. Bu tür bileşiklerden olan eflornitin, parazitik hastalık olan uyku hastalığının tedavisinde kullanılır.[60] Penisilin ve aspirin de benzer şekilde etkirler. Bu ilaçlar aktif merkeze bağlanınca enzim bunları etkinleşmiş bir şekle dönüştürür, bu da enzimin bir veya birkaç amino asit kalıntısı ile tersinmez olarak tepkir.
Etkisizleştiricilerin kullanımı
değiştirİnhibitörler sıkça ilaç olarak kullanılırlar ama zehir olarak da etki edebilirler. Paracelsus'un dediği gibi, "Her şeyde bir zehir vardır, zehirsiz bir şey yoktur,"[61] bir ilaç ile zehir arasındaki fark çoğu zaman miktara bağlıdır, çünkü çoğu ilaç belli bir seviyenin üzerinde zehirlidir. Antibiyotik ve diğer anti-enfeksiyon ilaçları aslında sadece bir batojeni öldürüp onun konağına zarar vermeyen seçici zehirlerdir.
Bir etksizleştiricinin (inaktivatörün) ilaç olarak kullanılmasına örnek COX-1 ve COX-2 enzimlerini inhibe eden aspirindir. Bu enzimler enflamasyon mesajcısı prostaglandin üreterek ağrı ve enflamasyonu bastırır. Siyanür zehiri, sitokrom C oksidaz enziminin aktif merkezinde bulunan demir ve bakır ile birleşerek etkiyen, tersinmez bir enzim inhibitörüdür, hücresel solunumu durdurur.[62]
Biyolojik işlev
değiştirEnzimler canlıların içinde çok çeşitli işlevlere sahiptir. Hücredeki diğer işlevlerin düzenlenmesi ve sinyal iletimi başlıca kinaz ve fosforilazlar aracılığıyla gerçekleşir.[63] Hareket sağlamak da enzimler sayesinde olur, miyozin tarafından ATP hidrolizi sonucunda kas kasılır, hücre iskeleti tarafından da hücre içinde yük taşınır.[64] Hücre zarında yer alan başka ATPazlar arasında aktif taşıma yapan iyon pompaları sayılabilir. Ateş böceklerinde lüsiferaz tarafından ışık üretimi gibi daha egzotik işlevler de enzimler tarafından yürütülür.[65] Virüsler hücreleri enfekte etmek için (AIDS virüsündeki HIV entegraz ve ters transkriptaz gibi) veya influenza virüsü'ündeki nöraminidaz gibi hücreden virüslerin salınması için kendi enzimlerini kullanırlar.
Enzimlerin önemli bir işlevi hayvanların sindirim sistemindedir. Amilaz ve proteaz tipi enzimler, nişasta ve protein gibi büyük molekülleri parçalayarak bunların bağırsak tarafından emilimini sağlar. Nişasta molekülleri, örneğin, ince bağırsak tarafından emilemeyecek kadar büyüktür ama enzimler nişasta zincirini hidrolizleyerek maltoz gibi daha küçük şekerlere ve en sonunda glukoza parçalar, bunlar da emilebilir. Farklı enzimler farklı gıda maddelerini sindirirler. Otobur olan geviş getiren hayvanların bağırsaklarında bulunan mikroorganizmalar bitki liflerindeki selülozlu hücre duvarlarını sindirmek için selüloz enzimini üretirler.[66]
Metabolizma
değiştirBirkaç enzim beraberce, belli bir sıra içinde çalışarak metabolik yolaklar meydana getirir. Metabolik bir yolakta, bir enzimin ürünü, bir diğeri tarafından substrat olarak kullanılır. Bazen birden çok enzim türü aynı tepkimeyi paralel olarak yürütebilir, böylece daha karmaşık düzenleme mümkün olur: bir enzim düşük seviyeli ve sabit bir etkinlik sağlarken diğeri ise tetiklenebilen (indüklenebilen) yüksek seviyeli bir etkinlik sağlar.
Bu metabolik yollardaki aşamalar enzimler tarafından belirlenir. Enzimler olmasa metabolizma ne bu aşamalardan geçebilir, ne de hücrenin gereksinimlerini sağlayacak kadar hızlı olur. Glikoliz gibi bir metabolik yol enzimler olmadan gerçekleşemez. Örneğin, glukoz ATP ile tepkiyerek bir veya daha çok karbon otumundan fosforlanabilir. Enzimler olmayınca bu tepkime anlamsız denecek derecede yavaş meydana gelir. Heksokinaz olunca bu yavaş tepkimeler gene devam eder ama karbon 6'daki fosforlanma o kadar hızlı gerçekleşir ki, kısa bir süre sonra karışım incelendiğinde glukoz-6-fosfat'ın anlamlı miktarda bulunan tek ürün olduğu görülür. Dolayısıyla, hücre içindeki metabolik yolların oluşturduğu ağ, mevcut olan enzimlerin kümesine bağlıdır.
Etkinlik kontrolü
değiştirHücrede enzim aktivitesinin kontrolünün 5 ana yolu vardır.
- Enzim üretimi (Enzim genlerinin yazılımı ve çevirimi) hücredeki ortamdaki değişikliklere bağlı olarak hızlandırılabilir veya yavaşlatılabilir. Gen düzenlenmesinin bu şekline enzim indüksiyonu ve inhbisyonu denir. Örneğin, bakteriler penisilin gibi antibiyotiklere karşı direnç geliştirebilir, çünkü penisilin molekülü için çok önemli olan beta-laktam halkasını hidrolzleyen beta laktamaz adlı enzimler indüklenir. Bir diğer örnek, ilaç metabolizmasında önemli yer tutan Sitokrom P450 oksidaz adlı karaciğer enzimleridir. Bu enzimlerin induksiyonu veya inhibisyonu, ilaç etkileşimlerine yol açabilir.
- Enzimler bölümlendirilebilir (compartmentalization), böylece farklı metabolik yollara farklı hücresel bölmelerde cereyan eder. Örneğin, yağ asitleri, sitozol, endoplazmik retikulum ve Golgi aygıtında bir grup enzim tarafından sentezlenir, sonra, mitokondride, enerji kaynağı olarak başka bir grup enzim tarafından kullanılır (β-oksidasyon yoluyla).[67]
- Enzimler, enzim inhibitörleri ve aktivatörleri tarafından düzenlenirler. Örneğin, bir metabolik yolun son ürünü sıkça bu yolun ilk enziminin (genelde ilk tersinmez ya da kesinleşmiş adımının-İng, committed step) inhibitörüdür, böylece yolun son ürününün miktarı düzenlenir. Bu bir negatif geri besleme mekanizmasıdır, çünkü son ürünün miktarı kendi konsantrasyonu tarafından düzenlenir. Negatif geri besleme mekanizmaları ara metabolitlerin sentezlenme hızını hücrenin gereksinimine göre etkili bir şekilde ayarlarlar. Bu sayede malzeme ve enerji verimli bir şekilde kullanılır ve son ürünlerin aşırı miktarda üretilmemesi sağlanır. Diğer homeostatik mekanizmalar gibi, enzim etkinliğinin kontrolü organizmanın içinde kararlı bir ortam sağlar.
- Enzimler çevrim sonrası değişim (İng. post-translational modification) aracılığıyla düzenlenir. Bu tür değişimler arasında fosforilasyon, miristoillenme ve glikozilasyon sayılabilir. Örneğin, vücuttaki insülin tepkisinde, glikojen sentaz gibi çeşitli enzimlerin fosforilasyonu, glikojenin sentez veya yıkımını kontrole yarar, böylece hücrelerin kan şekerine uygun cevap vermesini sağlar.[68] Cevirim sonrası değişime bir diğer örnek, polipeptit zincirin kesilmesidir. Bir sindirim proteazı olan kimotripsin, önce kimotripsinojen olarak inaktif bir sekilde pankreas tarafından üretilir, bu haliyle mideye taşindıktan sonra orada kesilerek etkinleştirilir. Böylece, sindirim yoluna girmeden enzimin pankreas ve diğer dokulara zarar vermesi engellenir. Bir enzimin bu tip inaktif öncül (prekürsör) haline zimojen denir.
- Bazı enzimler farklı bir ortamda yer alınca etkinleşirler (örneğin sitoplazmanın indirgeyici ortamından periplazmadaki yükseltgen ortamına veya yüksek pH'den düşük pH'ye). İnfluenza virüsündeki hemaglutinin, asitli ortamda meydana gelen biçimsel bir değişiklik ile etkinleşir, bu değişiklik hücre içine alındığı lizozomlara girdiğinde meydana gelir.[69]
Suyun etkisi:Enzimler ortamdaki su oranı yüzde 15 'in altına düştüğünde çalışmazlar.Ortamın su oranı yüzde 15 ve üzerine çıktığında tekrar etkinlik gösterir. Kuru yiyeceklerin bozulmadan kalması bu besinlerde üreyebilen mikrorganizmaların enzim etkinliğinin durmasından kaynaklanmaktadır.
Hastalıklarda yeri
değiştirEnzim etkinliğinin kontrolü homeostaz için zorunlu olduğu için, kritik bir enzimdeki herhangi bir bozukluk (mutasyon, aşırı üretim, az üretim veya yokluk) genetik hastalığa yol açabilir. Vücudumuzdaki binlerce enzimden bir tanesinin bozuk çalışmasının ölümcül bir hastalığa yol açabilmesi enzimlerin ne derece önemli olduklarını gösterir.
Bunun bir örneği, fenilketonuria hastalığının en yaygın olan tipidir. Fenilalanin yıkımının ilk adımını katalizleyen Fenilalanin hidroksilaz enziminin bir amino asidindeki mutasyon, fenilanin ve ilişkili ürünlerin vücutta birikimine yol açar. Hastalık tedavi edilmezse bu zekâ geriliğine yol açar.[70]
Bir diğer örnek, DNA tamir enzimlerinin genlerinde germ hücresi mutasyonları olunca, kseroderma pigmentosum gibi kalıtsal kanser sendromlarına neden olmasıdır. Bu enzimlerdeki kusurlar kansere yol açar, çünkü vücut genomdaki mutasyonları daha zor tamir edebilir. Bu yüzden mutasyonlar yavaş yavaş birikir ve bu, hastada çok çeşitli kanser tiplerinin gelişmesiyle sonuçlanır.
Endüstriyel uygulamalar
değiştirEnzimler, spesifik katalizörlere gerek duyulan kimya endüstrisinde ve diğer endüstriyel uygulamalarda kullanılır. Ancak, enzimler genelde katalizleyebildikleri tepkime sayısı, organik çözücü ve yüksek sıcaklıklarda stabiliteleri açısından sınırlıdırlar. Bu yüzden protein mühendisliği aktif bir araştırma sahası olmuştur, konusu yeni özelliklere sahip enzimlerin tasarımıdır. Bunun için ya rasyonel tasarım ya da laboratuvar ortamında (in vitro) evrim yöntemleri kullanılır.[71][72]
| Uygulama | Kullanılan enzim | Örnekler |
| Ekmek endüstrisi |
Fungal alfa-amilaz enzimleri normalde 50 derecede etkisizleşirler ve pişirme sırasında imha olurlar. | Undaki nişastanın şekere parçalanmasını katalizler. Mayanın şeker üzerindeki etkisi ile karbon dioksit meydana gelir. Ekmek ve ekmek ürünleri yapımında kullanılır.
|
| Proteazlar | Bisküvi imalatçıları undaki proteaz seviyesini azaltmak için kullanırlar. | |
| Bebek gıdaları | Tripsin | Bebek gıdalarının önceden sindirimi. |
| Alkol endüstrisi |
Bira üretiminde arpanın ezilmesi ile enzimler salınır. | Bu enzimler nişasta ve proteinleri parçalayarak basit şekerler, amino asitler ve peptitler üretir, bunlar da fermantasyonda kullanılır. |
| Arpa enzimlerinin endüstriyel üretimi | Biracılıkta yaygınca kullanılır, arpadaki doğal enzimler yerine kullanılırlar. | |
| Amilaz, glukanaz, proteazlar | Malttaki polisakkarit ve proteinleri parçalarlar. | |
| Betaglukanazlar ve arabinoksilanazlar | Arpa bulamacını (wort) ve biranın filtrelenme özelliklerini iyileştirirler. | |
| Amiloglukozidaz ve pullulanazlar | Düşük kalorili bira yapımı ve fermantasyonun ayarlanması. | |
| Proteazlar | Biranın saklanması sırasında oluşan bulanıklığın giderilmesi. | |
| Asetolaktatdekarboksilaz (ALDC) | Diasetil oluşumunu engellemek | |
| Meyve suları | Selulazlar, pektinazlar | Meyve sularının berraklaştırılması |
| Süt endüstrisi |
Genç geviş getirici hayvanların midesinden elde edilen Rennin. | Peynir üretimi, proteinin hidrolizi için. |
| Mikroplar tarafından üretilmiş enzim | Süt endüstrisinde artarak kullanılmaktadır. | |
| Lipazlar | Mavi küflü Rokfor peynirinin üretimi sırasında peynirin olgunlaşmasında kullanılır. | |
| Laktazlar | Laktozun glukoz ve galaktoza parçalar. | |
| Et yumuşatması | Papain | Pişirilecek etin yumuşamasını sağlar. |
| Nişasta endüstrisi | Amilazlar, amiloglucosideazlar ve glukoamilazlar | Nişastayı glukoza ve çeşitli şuruplara dönüştürür. |
| Glukoz izomeraz | Nişastalı malzemelerden yüksek fruktozlu mısır şurubu üretiminde glukozu fruktoza dönüştürür. Bu şurupların kuvvetli tatlandırıcı özellikleri ve ayni tatlılık derecesi için sükroza kıyasla daha düşük kalori değerleri vardır. | |
| Kağıt endüstrisi |
Amilaz, Ksilanaz, Selülaz ve ligninazlar | Nişastanın daha düşük viskoziteye indirerek kağıdın şekillenmesi ve kaplanmasını kolaylaştırır. Ksilinaz, renk gidermek için kullanılan çamaşır suyu miktarını azaltır. selülaz lifleri düzgünleştirir, su çekilmesini artırır ve mürekkep giderilmesini kolaylaştırır; lipazlar kalınlığı azaltır; ligninazlar lignini sindirip kağıdı yumuşatırlar |
| Biyoyakıt endüstrisi |
Selülazlar | Selülozu fermante edilebilir şekerlere parçalamak için kullanılır (bkz. selülozik etanol). |
| Ligninazlar | Lignin atıkların kullanımı | |
| Biyolojik çamaşır tozu | Başlıca proteazlar, bunlar bakteriler tarafından hücre dışına salgılanır | Giysilerden protein lekelerinin çıkarılması için. |
| Amilazlar | Bulaşık makinası deterjanlarında, dayanıklı nişasta lekelerinin çıkarılmasında. | |
| Lipazlar | Yağ lekelerinin çıkartılmasını kolaylaştırmak için. | |
| Selülazlar | Çamaşır yumuşatıcılarında kullanılır. | |
| kontakt lens temizleyicileri | Proteazlar | Enfeksiyon olmaması için kontakt lenslerden proteinleri çıkarmak. |
| Kauçuk endüstrisi | Katalaz | Peroksitten oksijen üretilerek lateksten sünger kauçuk imal etmek için. |
| Fotoğraf endüstrisi | Proteaz (fisin) | Artık fotoğraf filmindeki jelatini çözerek içindeki gümüşü elde etmek için. |
| Moleküler biyoloji |
Restriksiyon enzimleri, DNA ligaz ve polimerazlar | Gen mühendisliğinde DNA'nın manipülasyonu için, farmakoloji, tarım ve tıpta kullanılır. restriksiyon sindirimi ve polimeraz zincir reaksiyonu için esastırlar. Moleküler biyolojinin ayrıca adli tıpta de önemli bir yeri vardır. |
Ayrıca bakınız
değiştirNotlar
değiştir- ^ Smith AD (Ed) et al. (1997)) Oxford Dictionary of Biochemistry and Molecular Biology Oxford University Press. ISBN 0-19-854768-4
- ^ Garrett RH, Grisham CM. (1999) Biochemistry, Second Edition Saunders College Publishing. 426-427. ISBN 0-03-022318-0
- ^ Bairoch A. (2000). "The ENZYME database in 2000" (PDF). Nucleic Acids Res. Cilt 28. ss. 304-305. doi:10.1093/nar/28.1.304. PMID 10592255. 1 Haziran 2011 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Lilley D (2005). "Structure, folding and mechanisms of ribozymes". Curr Opin Struct Biol. 15 (3). ss. 313-23. doi:10.1016/j.sbi.2005.05.002. PMID 15919196.
- ^ Cech T (2000). "Structural biology. The ribosome is a ribozyme". Science. 289 (5481). ss. 878-9. doi:10.1126/science.289.5481.878. PMID 10960319.
- ^ de Réaumur, RAF (1752). "Observations sur la digestion des oiseaux". Histoire de l'academie royale des sciences. Cilt 1752. ss. 266, 461.
- ^ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences 9 Mayıs 2012 tarihinde Wayback Machine sitesinde arşivlendi. Harper and Brothers (New York) Accessed 4 April 2007
- ^ Dubos J. (1951). "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822-1895)-chance and the prepared mind". Trends Biotechnol. 13 (12). ss. 511-515. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ^ Nobel Laureate Biography of Eduard Buchner at http://nobelprize.org 29 Haziran 2016 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 4 April 2007
- ^ Text of Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org 8 Temmuz 2017 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 4 April 2007
- ^ 1946 Nobel prize for Chemistry laureates at http://nobelprize.org 5 Eylül 2015 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 4 April 2007
- ^ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution". Nature. 22 (206). ss. 757-761. doi:10.1038/206757a0. PMID 5891407.
- ^ "Chemistry - Queen Mary University of London". www.qmul.ac.uk. Queen Mary University. 5 Kasım 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Temmuz 2021.
- ^ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP (1992). "4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer". J. Biol. Chem. 267 (25). ss. 17716-21. PMID 1339435.
- ^ Smith S (1994). "The animal fatty acid synthase: one gene, one polypeptide, seven enzymes". Faseb J. 8 (15). ss. 1248-59. PMID 8001737. 22 Ocak 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Anfinsen C.B. (1973). "Principles that Govern the Folding of Protein Chains". Science. Cilt 181. ss. 223-230. doi:10.1126/science.181.4096.223. PMID 4124164.
- ^ The Catalytic Site Atlas at The European Bioinformatics Institute 27 Eylül 2018 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 4 April 2007
- ^ Jaeger KE, Eggert T. (2004). "Enantioselective biocatalysis optimized by directed evolution". Curr Opin Biotechnol. Cilt 15(4). ss. 305-313. doi:10.1016/j.copbio.2004.06.007. PMID 15358000.
- ^ Shevelev IV, Hubscher U. (2002). "The 3' 5' exonucleases". Nat Rev Mol Cell Biol. 3 (5). ss. 364-376. doi:10.1038/nrm804. PMID 11988770.
- ^ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ^ Zenkin N, Yuzenkova Y, Severinov K. (2006). "Transcript-assisted transcriptional proofreading". Science. Cilt 313. ss. 518-520. doi:10.1126/science.1127422. PMID 16873663.
- ^ Ibba M, Soll D. (2000). "Aminoacyl-tRNA synthesis". Annu Rev Biochem. Cilt 69. ss. 617-650. doi:10.1146/annurev.biochem.69.1.617. PMID 10966471.
- ^ Rodnina MV, Wintermeyer W. (2001). "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms". Annu Rev Biochem. Cilt 70. ss. 415-435. doi:10.1146/annurev.biochem.70.1.415. PMID 11395413.
- ^ Firn, Richard. "The Screening Hypothesis - a new explanation of secondary product diversity and function". 30 Ağustos 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Ekim 2006.
- ^ Fischer E. (1894). "Einfluss der Configuration auf die Wirkung der Enzyme". Ber. Dt. Chem. Ges. Cilt 27. ss. 2985-2993. doi:10.1002/cber.18940270364. 11 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Koshland D. E. (1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proc. Natl. Acad. Sci. 44 (2). ss. 98-104. doi:10.1073/pnas.44.2.98. PMID 16590179.
- ^ Vasella A, Davies GJ, Bohm M. (2002). "Glycosidase mechanisms". Curr Opin Chem Biol. 6 (5). ss. 619-629. doi:10.1016/S1367-5931(02)00380-0. PMID 12413546.
- ^ Boyer, Rodney. "6". Concepts in Biochemistry (İngilizce) (2. ed. bas.). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. ss. 137-138. ISBN 0-470-00379-0. Erişim tarihi: 21 Nisan 2007.
- ^ Fersht, A (1985) Enzyme Structure and Mechanism (2. ed) p50-52 W H Freeman & co, New York ISBN 0-7167-1615-1
- ^ Jencks W.P. "Catalysis in Chemistry and Enzymology." 1987, Dover, New York
- ^ Villa J, Strajbl M, Glennon TM, Sham YY, Chu ZT, Warshel A (2000). "How important are entropic contributions to enzyme catalysis?". Proc. Natl. Acad. Sci. U.S.A. 97 (22). ss. 11899-904. doi:10.1073/pnas.97.22.11899. PMID 11050223.
- ^ Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (2006). "Electrostatic basis for enzyme catalysis". Chemical Reviews. 106 (8). ss. 3210-35. doi:10.1021/cr0503106. PMID 16895325.
- ^ Eisenmesser EZ, Bosco DA, Akke M, Kern D. Enzyme dynamics during catalysis. Science. 2002 February 22;295(5559):1520-3. PMID 11859194
- ^ Agarwal PK. Role of protein dynamics in reaction rate enhancement by enzymes. J Am Chem Soc. 2005 November 2;127(43):15248-56. PMID 16248667
- ^ Eisenmesser EZ, Millet O, Labeikovsky W, Korzhnev DM, Wolf-Watz M, Bosco DA, Skalicky JJ, Kay LE, Kern D. Intrinsic dynamics of an enzyme underlies catalysis. Nature. 2005 November 3;438(7064):117-21. PMID 16267559
- ^ Yang LW, Bahar I. (Haziran 2005). "Coupling between catalytic site and collective dynamics: A requirement for mechanochemical activity of enzymes". Structure. Cilt 13. ss. 893-904. doi:10.1016/j.str.2005.03.015. PMID 15939021. 26 Mayıs 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Agarwal PK, Billeter SR, Rajagopalan PT, Benkovic SJ, Hammes-Schiffer S. (Mart 2002). "Network of coupled promoting motions in enzyme catalysis". Proc. Natl. Acad. Sci. U S A. Cilt 99. ss. 2794-9. doi:10.1073/pnas.052005999. PMID 11867722.
- ^ Agarwal PK, Geist A, Gorin A. Protein dynamics and enzymatic catalysis: investigating the peptidyl-prolyl cis-trans isomerization activity of cyclophilin A. Biochemistry. 2004 August 24;43(33):10605-18. PMID 15311922
- ^ Tousignant A, Pelletier JN. (Ağustos 2004). "Protein motions promote catalysis". Chem Biol. 11 (8). ss. 1037-42. doi:10.1016/j.chembiol.2004.06.007. PMID 15324804. 30 Kasım 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Kasım 2008.
- ^ Olsson M.H.M., Parson W.W. and Warshel A. "Dynamical Contributions to Enzyme Catalysis: Critical Tests of A Popular Hypothesis" Chem. Rev., 2006 105: 1737-1756
- ^ de Bolster, M.W.G. (1997). "Glossary of Terms Used in Bioinorganic Chemistry". International Union of Pure and Applied Chemistry. 10 Eylül 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Ekim 2007.
- ^ de Bolster, M.W.G. (1997). "Glossary of Terms Used in Bioinorganic Chemistry". International Union of Pure and Applied Chemistry. 10 Eylül 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Ekim 2007.
- ^ Fisher Z, Hernandez Prada JA, Tu C, Duda D, Yoshioka C, An H, Govindasamy L, Silverman DN and McKenna R. (2005). "Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II". Biochemistry. Cilt 44(4). ss. 1097-115. doi:10.1021/bi0480279. PMID 15667203.
- ^ AF Wagner, KA Folkers (1975) Vitamins and coenzymes. Interscience Publishers New York| ISBN 0-88275-258-8
- ^ BRENDA The Comprehensive Enzyme Information System 11 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi. 4 Nisan 2007'de ulaşılmıştır
- ^ Henri, V. (1902). "Theorie generale de l'action de quelques diastases". Compt. Rend. Hebd. Acad. Sci. Paris. Cilt 135. ss. 916-919.
- ^ Sørensen,P.L. (1909). "Enzymstudien {II}. Über die Messung und Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen". Biochem. Z. Cilt 21. ss. 131-304.
- ^ Michaelis L., Menten M. (1913). "Die Kinetik der Invertinwirkung". Biochem. Z. Cilt 49. ss. 333-369. English translation 9 Mayıs 2008 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 6 April 2007
- ^ Briggs G. E., Haldane J. B. S. (1925). "A note on the kinetics of enzyme action". Biochem. J. Cilt 19. ss. 339-339. PMID 16743508. 19 Mart 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Radzicka A, Wolfenden R. (1995). "A proficient enzyme". Science. 6 (267). ss. 90-931. doi:10.1126/science.7809611. PMID 7809611.
- ^ Ellis RJ (2001). "Macromolecular crowding: obvious but underappreciated". Trends Biochem. Sci. 26 (10). ss. 597-604. doi:10.1016/S0968-0004(01)01938-7. PMID 11590012.
- ^ Kopelman R (1988). "Fractal Reaction Kinetics". Science. 241 (4873). ss. 1620-26. doi:10.1126/science.241.4873.1620.
- ^ Savageau MA (1995). "Michaelis-Menten mechanism reconsidered: implications of fractal kinetics". J. Theor. Biol. 176 (1). ss. 115-24. doi:10.1006/jtbi.1995.0181. PMID 7475096.
- ^ Schnell S, Turner TE (2004). "Reaction kinetics in intracellular environments with macromolecular crowding: simulations and rate laws". Prog. Biophys. Mol. Biol. 85 (2-3). ss. 235-60. doi:10.1016/j.pbiomolbio.2004.01.012. PMID 15142746.
- ^ Xu F, Ding H (2007). "A new kinetic model for heterogeneous (or spatially confined) enzymatic catalysis: Contributions from the fractal and jamming (overcrowding) effects". Appl. Catal. A: Gen. 317 (1). ss. 70-81. doi:10.1016/j.apcata.2006.10.014.
- ^ Masgrau L., Roujeinikova A., Johannissen L. O., Hothi P., Basran J., Ranaghan K. E., Mulholland A. J., Sutcliffe M. J., Scrutton N. S., Leys D. (2006). "Atomic Description of an Enzyme Reaction Dominated by Proton Tunneling". Science. 312 (5771). ss. 237-241. doi:10.1126/science.1126002. PMID 16614214.
- ^ Garcia-Viloca M., Gao J., Karplus M., Truhlar D. G. (2004). "How enzymes work: analysis by modern rate theory and computer simulations". Science. 303 (5655). ss. 186-195. doi:10.1126/science.1088172. PMID 14716003.
- ^ Olsson M. H., Siegbahn P. E., Warshel A. (2004). "Simulations of the large kinetic isotope effect and the temperature dependence of the hydrogen atom transfer in lipoxygenase". J. Am. Chem. Soc. 126 (9). ss. 2820-1828. doi:10.1021/ja037233l. PMID 14995199.
- ^ Cleland, W.W. (1963). "The Kinetics of Enzyme-catalyzed Reactions with two or more Substrates or Products 2. {I}nhibition: Nomenclature and Theory". Biochim. Biophys. Acta. Cilt 67. ss. 173-187.
- ^ Poulin R, Lu L, Ackermann B, Bey P, Pegg AE. Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites. 24 Ocak 2009 tarihinde Wayback Machine sitesinde arşivlendi. J Biol Chem. 1992 January 5;267(1):150-8. PMID 1730582
- ^ Ball, Philip (2006) The Devil's Doctor: Paracelsus and the World of Renaissance Magic and Science. Farrar, Straus and Giroux ISBN 0-374-22979-1
- ^ Yoshikawa S and Caughey WS. (Mayıs 1990). "Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction". J Biol Chem. 265 (14). ss. 7945-7958. PMID 2159465. 25 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Hunter T. (1995). "Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling". Cell. Cilt 80(2). ss. 225-236. doi:10.1016/0092-8674(95)90405-0. PMID 7834742.
- ^ Berg JS, Powell BC, Cheney RE. (2001). "A millennial myosin census". Mol Biol Cell. Cilt 12(4). ss. 780-794. PMID 11294886.[ölü/kırık bağlantı]
- ^ Meighen EA. (1991). "Molecular biology of bacterial bioluminescence". Microbiol Rev. Cilt 55(1). ss. 123-142. PMID 2030669.[ölü/kırık bağlantı]
- ^ Mackie RI, White BA (1990). "Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output". J. Dairy Sci. 73 (10). ss. 2971-95. PMID 2178174. 21 Kasım 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Faergeman N. J, Knudsen J. (Nisan 1997). "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". Biochem J. Cilt 323. ss. 1-12. PMID 9173866.[ölü/kırık bağlantı]
- ^ Doble B. W., Woodgett J. R. (Nisan 2003). "GSK-3: tricks of the trade for a multi-tasking kinase". J. Cell. Sci. Cilt 116. ss. 1175-1186. doi:10.1242/jcs.00384. PMID 12615961. 30 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2008.
- ^ Carr C. M., Kim P. S. (Nisan 2003). "A spring-loaded mechanism for the conformational change of influenza hemagglutinin". Cell. Cilt 73. ss. 823-832. doi:10.1016/0092-8674(93)90260-W. PMID 8500173.
- ^ Phenylketonuria: NCBI Genes and Disease 27 Eylül 2009 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 4 April 2007
- ^ Renugopalakrishnan V, Garduno-Juarez R, Narasimhan G, Verma CS, Wei X, Li P. (2005). "Rational design of thermally stable proteins: relevance to bionanotechnology". J Nanosci Nanotechnol. 5 (11). ss. 1759-1767. doi:10.1166/jnn.2005.441. PMID 16433409.
- ^ Hult K, Berglund P. (2003). "Engineered enzymes for improved organic synthesis". Curr Opin Biotechnol. 14 (4). ss. 395-400. doi:10.1016/S0958-1669(03)00095-8. PMID 12943848.
Dış bağlantılar
değiştir- Enzyme spotlight 18 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi. Avrupa biyoenformatik enstitüsünün her ay seçilmiş bir enzim hakkındaki yazısı.
- BRENDA veritabanı, tüm bilinen enzimler hakkındaki bilgi ve literatür referanslarının derlemesi; ticari kullanıcıların ücret ödemesi gerekiyor.
- Enzim yapı veritabanı 3 Nisan 2013 tarihinde Wayback Machine sitesinde arşivlendi. Protein Data Bank'da 3-boyutlu yapısı bilinen enzimlere bağlantılar.
- ExPASy enzim6 Ekim 2006 tarihinde Wayback Machine sitesinde arşivlendi. veritabanı, Swiss-Prot dizi verileri, diğer veritabanları ve ilgili literatür aramalarına bağlantılar.
- KEGG: Kyoto Encyclopedia of Genes and Genomes 6 Mayıs 2009 tarihinde Wayback Machine sitesinde arşivlendi. Biyokimyasal yol ve enzimler hakkında grafik ve hipermetin tabanlı bilgi.
- MACiE Enzim reaksiyon mekanizmaları veritabanı.
- MetaCyc enzim ve metabolik yollar veritabanı
- Sigma Aldrich Enzyme Ölçüm kitleri listesi, enzim ismine göre sıralanmış - Yüzlerce ölçüm yöntemi, enzim adına göre sıralanmış.