Kalsiyum nitrat
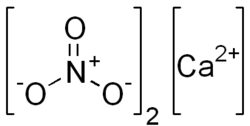
Kalsiyum nitrat, (Norveç güherçilesi) olarak da adlandırılır. Ca(NO3)2 formülüne sahip bir inorganik bileşiktir. Bu renksiz tuz havadan nem çeker ve genellikle bir tetrahidrat olarak bulunur. Esas olarak gübrelerde bileşen olarak kullanılırsa da başka uygulamalarda da kullanılır. Nitrokalsit, çiftlik gübresinin ahır veya mağaralarda olduğu gibi kuru bir ortamda beton veya kireç taşı ile temas ettiği yerlerde bir çiçeklenme olarak oluşan hidratlı bir kalsiyum nitrat olan bir mineralin adıdır. Kalsiyum amonyum nitrat dekahidrat ve kalsiyum potasyum nitrat dekahidrat dahil çeşitli ilgili tuzları bilinmektedir.[2]
| |

| |
Diğer adlar Norveç güherçilesi, Kalsiyum güherçilesi, nitrokalsit | |
| Tanımlayıcılar | |
|---|---|
| |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.030.289 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
| UN numarası | 1454 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | Ca(NO3)2 |
| Molekül kütlesi | 164.088 g/mol (susuz) 236.15 g/mol (tetrahidrat) |
| Görünüm | renksiz katı higroskopik |
| Yoğunluk | 2.504 g/cm3 (susuz) 1.896 g/cm3 (tetrahidrat) |
| Erime noktası | 561 °C (susuz) 42.7 °C (tetrahidrat) |
| Kaynama noktası | bozunur (susuz) 132 °C (tetrahidrat) |
| Çözünürlük (su içinde) | susuz: 1212 g/L (20 °C) 2710 g/L (40 °C) tetrahidrat: 1050 g/L (0 °C) 1290 g/L (20 °C) 3630 g/L (100 °C) |
| Çözünürlük | amonyakta çözünür nitrik asitte çözünmez |
| Çözünürlük (etanol içinde) | 51.4 g/100 g (20 °C) 62.9 g/100 g (40 °C)[1] |
| Çözünürlük (metanol içinde) | 134 g/100 g (10 °C) 144 g/100 g (40 °C) 158 g/100 g (60 °C)[1] |
| Çözünürlük (aseton içinde) | 16.8 g/kg (20 °C)[1] |
| Asitlik (pKa) | 6.0 |
| -45.9•10−6 cm3/mol | |
| Yapı | |
| kübik (susuz) monoklinik (tetrahidrat) | |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |   
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H272, H302, H315, H319 |
| Önlem ifadeleri | P210, P220, P221, P264, P270, P280, P301+P312, P302+P352, P305+P351+P338, P310, P321, P330, P332+P313, P337+P313, P362, P370+P378, P501 |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | Yanıcı değildir |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
302 mg/kg (sıçan, oral) |
| Güvenlik bilgi formu (SDS) | ICSC 1037 |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Kalsiyum sülfat Kalsiyum klorür |
Diğer katyonlar
|
Magnezyum nitrat Stronsiyum nitrat Baryum nitrat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Üretimi ve reaktifliği
değiştirNorveç güherçilesi, 1905 yılında Notodden, Norveç’te Birkeland–Eyde işlemi ile sentezlendi. Dünyadaki kalsiyum nitratın çoğu artık Porsgrunn’da üretilmektedir.
Kireçtaşının nitrik asit ile işlenmesi ve ardından amonyak ile nötrleştirilmesi ile üretilir:
- CaCO3 + 2 HNO3 → Ca(NO3)2 + CO2 + H2O
Ayrıca, Odda İşlemi’nin bir ara ürünüdür:
- Ca3(PO4)2 + 6 HNO3 + 12 H2O → 2 H3PO4 + 3 Ca(NO3)2 + 12 H2O
Sulu bir amonyum nitrat ve kalsiyum hidroksit çözeltisinden de hazırlanabilir::
- 2 NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2 NH4OH
İlgili toprak alkali metal nitratları gibi, kalsiyum nitrat ısıtıldığında ( 500 °C’de başlar) azot dioksit vererek bozunur:[2]
- 2 Ca(NO3)2 → 2 CaO + 4 NO2 + O2 ΔH = 369 kJ/mol
Uygulamaları
değiştirTarımda kullanımı
değiştirGübre olarak (15.5-0-0 + %19 Ca) içerir ve sera ve hidroponik uygulamalarında çok yaygın kullanılır; "çift tuz" olarak, amonyum nitrat ve su içerir: 5Ca(NO3)2.NH4NO3.10H2O. Bu gübreye kalsiyum amonyum nitrat(CAN) denir. Amonyak içermeyen formülasyonlar da bilinmektedir: Ca(NO3)2•4H2O (11.9-0-0 + 16.9 Ca) ve susuz 17-0-0 + 23.6 Ca. Sıvı bir formülasyon da (9-0-0 + 11 Ca) mevcuttur. An Susuz, havaya karşı kararlı bir türevide Cal-Üre olarak satılan üre kompleksidir. Formülü, Ca(NO3)2•4[OC(NH2)2] olarak gösterilebilir.
Kalsiyum nitrat ayrıca bazı fizyolojik bitki hastalıklarını kontrol etmek için kullanılır. Örneğin, seyreltik kalsiyum nitrat (ve kalsiyum klorür) çözeltileri, elma ağaçlarındaki kalsiyum eksikliği ve elma meyvelerindeki acı benek hastalığı için püskürtme şeklinde uygulanır.[3]
Atık su arıtma
değiştirKalsiyum nitrat, koku emisyonunu önlemek için atık su ön şartlandırmada kullanılır. Atık su ön şartlandırması, atık su sisteminde oksijensiz bir biyoloji oluşturulmasına dayanmaktadır. Nitrat varlığında, sülfatların metabolizması durur, böylece hidrojen sülfür oluşumu önlenir.[4] Ek olarak kolay bozunabilir organik madde tüketilir, aksi takdirde aşağı yönde anaerobik koşullara ve koku emisyonlarının kendisine neden olabilir. Uygulanan konsept, ayrıca artık çamur arıtımı için de geçerlidir.[5]
Beton
değiştirPriz hızlandırıcı beton katkılarında kalsiyum nitrat kullanılır. Beton ve harç ile yapılan bu kullanım iki etkiye dayanmaktadır. Kalsiyum iyonu kalsiyum hidroksit oluşumunu hızlandırır ve böylece çökelme ve priz süresini hızlandırır. Bu etki, soğuk hava betonlama maddelerinin yanı sıra bazı kombine plastikleştiricilerde de kullanılır.[6] Nitrat iyonu, betonarmedeki çelik takviyenin korozyonunu azaltan, koruyucu bir tabaka ve korozyon önleyici olarak demir hidroksit oluşumuna yol açar.[7]
Lateks pıhtılaştırıcı
değiştirKalsiyum nitrat, özellikle daldırma işlemlerinde lateks üretiminde çok yaygın bir pıhtılaştırıcıdır. Çözünmüş kalsiyum nitrat daldırma banyosu çözeltisinin bir parçasıdır. Sıcak oluşturucu pıhtılaşma sıvısına daldırılır ve daldırıcı sıvının ince bir film tabakası, öncekinin üzerinde kalır. Oluşturucu latekse daldırıldığında, kalsiyum nitrat lateks çözeltisinin stabilitesini bozar ve lateks öncekinin üzerinde pıhtılaşır.[8][9]
Soğuk paketler
değiştirKalsiyum nitrat tetrahidratın çözünmesi oldukça endotermiktir (soğutma). Bu nedenle, kalsiyum nitrat tetrahidrat bazen yenilenebilir soğuk paketler için kullanılır.[2]
Isı transferi ve depolanması için erimiş tuzlar
değiştirKalsiyum nitrat ergimiş tuz karışımlarının bir parçası olarak kullanılabilir. Tipik olarak bu karışımlar, ikili kalsiyum nitrat ve potasyum nitrat karışımları veya ayrıca sodyum nitrat dahil üçlü karışımlardır.[10][11][12] Bu ergimiş tuzlar, ısı transferi için konsantre güneş enerjisi santrallerindeki ısı transfer yağı yerine kullanılabilirse de çoğunlukla ısı depolamada kullanılır.
Kaynakça
değiştir- ^ a b c Anatolievich, Kiper Ruslan. "Properties of substance: calcium nitrate". 24 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Eylül 2015.
- ^ a b c Wolfgang Laue, Michael Thiemann, Erich Scheibler, Karl Wilhelm Wiegand "Nitrates and Nitrites" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.DOI:10.1002/14356007.a17_265. Article Online Posting Date: June 15, 2000
- ^ "Bitter Pit and Cork Spot". University of Wisconsin-Extension Cooperative Extension. UW-Madison, Dept of Horticulture. 18 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2020.
- ^ Bentzen, G; Smith, A; Bennett, D; Webster, N; Reinholt, F; Sletholt, E; Hobson, J (1995). "Controlled dosing of nitrate for prevention of H2S in a sewer network and the effects on the subsequent treatment process". Water Science and Technology. 31 (7): 293. doi:10.1016/0273-1223(95)00346-O.
- ^ Einarsen, A.M.; ÆeesØy, A.; Rasmussen, A. I.; Bungum, S.; Sveberg, M. (2000). "Biological prevention and removal of hydrogen sulphide in sludge at Lillehammer Wastewater Treatment Plant". Water Sci. Technol. 41 (6): 175-187. doi:10.2166/wst.2000.0107.
- ^ Justines, H. (2010) "Calcium Nitrate as a Multifunctional Concrete Admixture" Concrete Magazine, Vol 44, No. 1, p.34. ISSN 0010-5317
- ^ Al-Amoudi, Omar S.Baghabra; Maslehuddin, Mohammed; Lashari, A.N; Almusallam, Abdullah A (2003). "Effectiveness of corrosion inhibitors in contaminated concrete". Cement and Concrete Composites. 25 (4–5): 439. doi:10.1016/S0958-9465(02)00084-7.
- ^ N. C. Dafader, Y. N. Jolly, M. E. Haque, F. Akhtar & M. U. Ahmad: The Role of Coagulants on the Preparation of Dipped film from Radiation Vulcanized Natural Rubber Latex. Polymer-Plastics Technology and Engineering. Volume 38, Issue 2, 1999, pages 267-274. Online: http://www.tandfonline.com/doi/abs/10.1080/03602559909351576
- ^ "Rubbercare - Choice Latex and Nitrile Gloves from a Trusted Manufacturer". 1 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2020.
- ^ "Potassium calcium nitrate promising for CSP heat storage – Solar Novus Today". 18 Ağustos 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2020.
- ^ European Patent Application EP0049761: Use of a ternary mixture of salts as a heat transmitting medium and/or as a heat storage medium. http://www.freepatentsonline.com/EP0049761A1.html 7 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ WIPO Patent Application WO/2014/044652: Use of a calcium potassium nitrate salt for the manufacture of a heat transfer fluid. http://www.freepatentsonline.com/WO2014044652A1.html 6 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||
