Amonyum nitrat
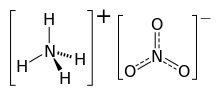
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır.[3] 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.
| |

| |

| |
| Adlandırmalar | |
|---|---|
Amonyum nitrat | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.026.680 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
| UN numarası | 0222 – > %0.2 yanıcı maddelerle 1942 – ≤ %0.2 yanıcı maddelerle 2067 – gübreler 2426 – sıvı |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | NH4NO3 |
| Molekül kütlesi | 80,043 g/mol |
| Görünüm | renksiz |
| Yoğunluk | 1,725 g/cm3 (20 °C) |
| Erime noktası | 169,6 °C (337,3 °F; 442,8 K) |
| Kaynama noktası | 210 °C (410 °F; 483 K) bozunur |
| Çözünürlük (su içinde) | Endotermik 118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C)[1] |
| -33,6•10−6 cm3/mol | |
| Yapı | |
| trigonal | |
| Patlayıcı verileri | |
| Şok duyarlılığı | çok düşük |
| Sürtünme duyarlılığı | çok düşük |
| Patlama hızı | 2500 m/s |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Patlayıcı, Oksitleyici |
| GHS etiketleme sistemi: | |
| Piktogramlar |   
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H201, H271, H319 |
| Önlem ifadeleri | P220, P221, P264, P271, P280, P372 |
| NFPA 704 (yangın karosu) |
|
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
2085–5300 mg/kg (oral, sıçan ve fareler)[2] |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Amonyum nitrit |
Diğer katyonlar
|
Sodyum nitrat Potasyum nitrat Hidroksilamonyum nitrat |
Benzeyen bileşikler
|
Amonyum perklorat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Diğer önemli kullanımı, madencilik, taş ocakçılığı ve inşaat yapımında kullanılan patlayıcı madde karışımlarının bir bileşenidir. Kuzey Amerika'da kullanılan patlayıcıların % 80'ini oluşturan popüler bir endüstriyel patlayıcı olan ANFO'nun ana bileşenidir; benzer formülasyonlar, el yapımı patlayıcılarda kullanılmıştır.
Birçok ülke, kötüye kullanım potansiyeline ilişkin endişeler nedeniyle tüketici başvurularında kullanımını aşamalı olarak durdurmaktadır.[4] Kaza ile oluşmuş amonyum nitrat patlamaları 20. yüzyılın başından beri binlerce insanın ölümüne sebep olmuştur.
Oluşumu
değiştirAmonyum nitrat, Şili'deki Atacama Çölünün en kurak bölgelerinde doğal mineral gwihabaite – güherçilenin amonyum benzeri – olarak, genellikle yerdeki bir kabuk olarak veya diğer nitrat, iyodat ve halojenür mineralleri ile birlikte bulunur. Amonyum nitrat geçmişte oradan çıkarıldıysa da günümüzde kullanılan amonyum nitratın neredeyse %100'ü sentetiktir.
Üretimi, reaksiyonları ve kristal fazları
değiştirAmonyum nitratın endüstriyel üretimi amonyakın nitrik asitle asit-baz reaksiyonunu gerektirir:[5]
- HNO3 + NH3 → NH4NO3
Amonyak susuz haliyle (gaz) ve nitrik asit derişik olarak kullanılır. Reaksiyon şiddetli gerçekleştiği için son derece ekzotermiktir. Tipik olarak, yaklaşık %83'lük derişimde çözelti oluşturulduktan sonra, dereceye göre % 95 - 99.9 konsantrasyonunda (erimiş AN), amonyum nitrat (AN) bırakmak için fazla su buharlaştırılır. Erimiş AN daha sonra bir püskürtme kulesinde "pril" veya küçük taneler veyahutta döner bir tambur içinde püskürtme ve yuvarlama yoluyla granüller haline getirilir. Priller veya granüller ayrıca kurutulabilir, soğutulabilir ve daha sonra kekleşmeyi önlemek için kaplanabilir. Bu priller veya granüller, ticarette tipik AN ürünleridir.
Bu işlem için gerekli amonyak, azot ve hidrojenden Haber işlemi ile elde edilir. Haber işlemi ile üretilen amonyak, Ostwald işlemi ile nitrik aside oksitlenebilir. Başka bir üretim yöntemi, nitrofosfat işleminin bir çeşididir:
Kalsiyum karbonat ve amonyum nitrat ürünleri, ayrı ayrı saflaştırılabilir veya karma gübre olarak kalsiyum amonyum nitrat adıyla satılabilir.
Amonyum nitrat yer değiştirme reaksiyonları yoluyla da yapılabilir:
Reaksiyonları
değiştirAmonyum nitrat bir tuz olduğu için, hem NH4+ katyonu hem de NO3− anyonu kimyasal reaksiyonlarda yer alabilir.
Katı amonyum nitrat ısındığında ayrışır. Yaklaşık 300 °C'nin altındaki sıcaklıklarda, bozunma esas olarak nitröz oksit ve su üretir:
- NH4NO3 → N2O + 2H2O
Daha yüksek sıcaklıklarda, aşağıdaki reaksiyon baskındır.[6]
- 2NH4NO3 → 2N2 + O2 + 4H2O
Her iki ayrışma reaksiyonu da ekzotermiktir ve ürünleri gazdır. Belirli koşullar altında, bu ayrışma sürecinin patlayıcı hale gelmesiyle bir denetimsiz tepkimeye yol açabilir.[7] Bu denetimsiz tepkimenin sonucu olarak, can kaybıyla birlikte birçok amonyum nitrat felaketleri meydana gelmiştir.
Bir patlama bulutundaki kırmızı-turuncu renk, ikincil bir reaksiyon ürünü olan azot dioksitten kaynaklanır.[7]
Kristal fazları
değiştirBirkaç kristalli amonyum nitrat fazı gözlemlenmiştir. Atmosferik basınç altında aşağıdakiler meydana gelir.
Faz Sıcaklık (°C) Simetri (sıvı) (169.6'nin üstü) I 169.6 - 125.2 kübik II 125.2 - 84.2 tetragonal III 84.2 - 32.3 α-rombik IV 32.3 - −16.8 β-rombik V −16.8'nın altında tetragonal[8]
Hem β-rombik hem de α-rombik formlar potansiyel olarak dünyanın birçok yerinde ortam sıcaklığında bulunur, ancak yoğunlukta % 3.6 fark vardır. Sonuç olarak, amonyum nitratın bu faz geçişi ve hacim değişikliği katılması oluşumu katı yakıtlı roket motoru itici yakıtında çatlakları geliştirir. Bu nedenle, stabilizatör olarak metal halojenürleri içeren faz stabilize amonyum nitrat (PSAN) araştırılmıştır.[9]
Kullanım alanları
değiştirGübre
değiştirAmonyum nitrat NPK oranı 34-0-0 (%34 azot) olan önemli bir gübredir.[10] Üre’den (46-0-0) daha az konsantredir ve amonyum nitrata hafif bir taşıma dezavantajı verir. Amonyum nitratın üreye göre avantajı, daha kararlı olması ve azotu atmosfere hızla kaybetmemesidir.
Patlayıcı madde
değiştirAmonyum nitrat, bazı patlayıcılarda bulunan bir bileşendir. Amonyum nitrat içeren patlayıcı örnekleri şunları içerir:
- Astrolit (amonyum nitrat ve hidrazin roket yakıtı)
- Amatol (amonyum nitrat ve TNT)
- Ammonal (amonyum nitrat ve alüminyum tozu)
- Amateks (amonyum nitrat, TNT ve RDX)
- ANFO (amonyum nitrat ve fuel oil)
- DBX (amonyum nitrat, RDX, TNT ve alüminyum tozu)
- Toveks (amonyum nitrat ve metilamonyum nitrat)
- Minol (patlayıcı) (amonyum nitrat, TNT ve alüminyum tozu)
- Goma-2 (amonyum nitrat, nitroglikol, Nitroselüloz, Dibütil ftalat ve yakıt)
Fuel oil ile karışımı
değiştirANFO, yaygın endüstriyel patlayıcı olarak kullanılan % 94 amonyum nitrat ("AN") ve % 6 fuel oil ("FO") karışımıdır.[11]:1 Kömür madenciliği, taş ocakçılığı, metal madenciliği ve inşaat yapımında ANFO'nun düşük maliyeti ve kullanım kolaylığının avantajlarının, suya dayanıklılık, oksijen dengesi, yüksek patlama hızı ve küçük çaplarda performans gibi geleneksel endüstriyel patlayıcıların sunduğu faydalardan daha önemli olduğu basit uygulamalarda kullanılır.[11]:2
Terörizm
değiştir1970 yılında Madison, Wisconsin'deki Sterling Hall bombalamasında, 1995 yılında Oklahoma City bombalamasında, 2003 İstanbul saldırılarında, 2011 Delhi bombalamasında, 2011 Oslo bombalamasında ve 2013 Haydarabad patlamalarında amonyum nitrat bazlı patlayıcılar kullanıldı.
Kasım 2009'da, Pakistan’ın Hayber Pahtunhva (NWFP) eyaleti, Upper Dir, Lower Dir, Svat, Çitral ve NWFP’nin Malakand bölgelerini içeren eski Malakand Bölgesinde amonyum sülfat, amonyum nitrat ve kalsiyum amonyum nitrat gübrelerinin militanlar tarafından patlayıcı yapmak için kullanıldığına dair raporların ardından bu gübrelere yasak getirdi. Bu yasaklar nedeniyle, isyancılar patlayıcı madde yapımında gübreden daha çok potasyum klorat kullanmaya başladılar.[12]
Özelleşmiş kullanımlar
değiştirAmonyum nitrat, suda çözünmesi oldukça endotermik olduğundan bazı hazır soğuk paketlerde kullanılır. Ayrıca guanidin nitrat gibi bağımsız patlayıcı "yakıtlar" ile kombinasyon halinde,[13][14] Takata Şirketi tarafından üretilen hava yastığının şişiricilerinde 5-aminotetrazol daha ucuz (ancak daha az kararlı) bir alternatif olarak kullanıldı ve 14 kişiyi öldürdükten sonra güvensiz olduğundan dolayı bu ürünler geri çağrılmıştır.[15]
Cavea-b adı verilen nitrik asitli bir amonyum nitrat çözeltisi, yaygın tek bazlı itici yakıt olan hidrazine daha enerjik bir alternatif olarak uzay araçlarında kullanım için umut verdi. 1960'larda bir dizi deneme yapıldı, ancak madde NASA tarafından kabul edilmedi.
Güvenlik, kullanma ve depolama
değiştirAmonyum nitratın depolanması ve kullanılması için çok sayıda güvenlik yönergesi mevcuttur. Sağlık ve güvenlik verileri, tedarikçilerden ve çeşitli yönetimlerden temin edilebilen güvenlik bilgi formunda gösterilir.[16][17][18]
Saf amonyum nitrat nitrat yanmaz, ancak güçlü bir oksitleyici olarak organik (ve bazı inorganik) maddelerin yanmasını destekler ve hızlandırır.[16][19][20] Yanıcı maddelerin yakınında depolanmamalıdır.
Amonyum nitrat, ortam sıcaklığında ve basıncında birçok koşulda kararlı iken, güçlü bir ateşleyici başlangıç yüküyle patlayabilir. Yüksek patlayıcıların veya patlatma maddelerinin yakınında depolanmamalıdır.
Erimiş amonyum nitrat, özellikle yanıcı maddeler, yanıcı sıvılar, asitler, kloratlar, klorürler, kükürt, metaller, odun kömürü ve talaş gibi uyumsuz maddelerle bulaştığında şok ve patlamaya karşı çok hassastır.[16][21]
Kloratlar, mineral asitler ve metal sülfürler gibi belirli maddelerle teması, yakındaki yanıcı maddeleri tutuşturabilecek veya patlayabilecek kuvvetli ve hatta şiddetli ayrışmaya neden olabilir.[22][23]
Amonyum nitrat eridikten sonra ayrışmaya başlar ve NOx, HNO3, NH3 ve H2O oluşur. Kapalı bir alanda ısıtılmamalıdır.[16] Ayrışmadan kaynaklanan ısı ve basınç, patlamaya duyarlılığı artırır ve ayrışma hızını artırır. 80 atmosferde patlama meydana gelebilir. Bulaşma bunu 20 atmosfere indirebilir.[21]
Amonyum nitrat %59.4 kritik bağıl neme sahiptir ve bunun üzerinde atmosferdeki nemi emer. Bu nedenle, amonyum nitratın sıkıca kapatılmış bir kapta saklanması önemlidir. Aksi takdirde, büyük, katı bir kütle halinde taşlaşabilir. Amonyum nitrat sıvılaşmak için yeterli nemi emebilir. Amonyum nitratın diğer bazı gübrelerle karıştırılması kritik bağıl nemi düşürebilir.[24]
Maddenin patlayıcı olarak kullanılma potansiyeli, yasal önlemlere yol açmıştır. Örneğin, Avustralya'da, Tehlikeli Maddeler Yönetmeliği, bu tür maddelerle ilgili lisanslamayı uygulamak için Ağustos 2005'te yürürlüğe girdi.[25] Lisanslar, herhangi bir kötüye kullanımı önlemek için uygun güvenlik önlemleri alınarak yalnızca başvuru sahiplerine (endüstri) verilir.[26] Bireysel kullanım olmayacak şekilde eğitim ve araştırma amaçlı gibi ek kullanımlar da düşünülebilir. Maddeyle ilgilenme ruhsatına sahip çalışanların yine de yetkili personel tarafından denetlenmesi ve bir ruhsat verilmeden önce güvenlik ve ulusal polis kontrolünden geçmeleri gerekmektedir.
Sağlık tehlikeleri
değiştirSağlık ve güvenlik verileri, tedarikçilerden temin edilebilen ve internette bulunabilen malzeme güvenlik bilgi formunda gösterilir.[27]
Amonyum nitrat sağlığa zararlı değildir ve genellikle gübre ürünlerinde kullanılır.[27][28][29]
Amonyum nitratın LD50'si 2217 mg/kg'dır.[30] Bu değeri karşılaştırmak gerekirse, sofra tuzunun yaklaşık üçte ikisi kadardır.
Felaketler
değiştirAmonyum nitrat ısıtıldığında, patlamadan, nitröz oksit gazlarına ve su buharına ayrışır. Bununla birlikte, patlama ile patlayarak ayrışması sağlanabilir.[31] Maddenin büyük miktarda stoklanması, destekleyici oksitlenmeleri nedeniyle de büyük bir yangın riski oluşturabilir, bu durum kolayca patlamaya neden olabilir. Patlamalar nadir değildir: çoğu yıl nispeten küçük olaylar meydana gelir ve birkaç büyük ve yıkıcı patlama da meydana gelir. Örnekler arasında, 1921 yılı Oppau patlaması (nükleer olmayan en büyük yapay patlamalardan biri), 1947 yılı Texas City felaketi, Çin'deki 2015 Tianjin patlamaları ve 2020 Beyrut patlamaları sayılabilir.[32]
Amonyum nitrat iki mekanizma yoluyla patlayabilir:
- Şoktan patlamaya geçiş. Bir amonyum nitrat kütlesi içinde veya bu kütleyle temas halinde olan patlayıcı bir yük, amonyum nitratın patlamasına neden olur. Bu tür felaketlerin örnekleri Kriewald, Morgan (bugünkü Sayreville, New Jersey), Oppau ve Tessenderlo patlamalarıdır.
- Tutuşarak patlamaya geçiş. Amonyum nitrat patlaması, amonyum nitrata sıçrayan bir yangından (Texas City, TX; Brest; West, TX; Tianjin; Beyrut) veya yangın sırasında yanıcı bir maddeyle karışan amonyum nitrattan (Repauno, Cherokee, Nadadores) kaynaklanır. Yangından patlamaya başarılı bir şekilde geçiş için yangının en azından bir dereceye kadar sınırlanmış olması gerekir.
Ayrıca bakınız
değiştirKaynakça
değiştir- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, 0-07-049439-8
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. s. 362. ISBN 1-903996-65-1.
- ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a02_243
- ^ Ammonium nitrate sold by ton as U.S. regulation is stymied. 28 Şubat 2018 tarihinde Wayback Machine sitesinde arşivlendi. – The Dallas Morning News
- ^ "Archived copy" (PDF). 23 Ocak 2012 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 11 Kasım 2008.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. s. 469. ISBN 0080379419.
- ^ a b "The chemistry behind the Beirut explosion". 14 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ağustos 2020.
- ^ Choi, C. S.; Prask, H. J. (1983). "The structure of ND4NO3 phase V by neutron powder diffraction". Acta Crystallographica B. 39 (4): 414-420. doi:10.1107/S0108768183002669 .
- ^ Kumar, Pratim (Aralık 2019). "Advances in phase stabilization techniques of AN using KDN and other chemical compounds for preparing green oxidizers". Defence Technology. 15 (6): 949-957. doi:10.1016/j.dt.2019.03.002.
- ^ "Nutrient Content of Fertilizer Materials" (PDF). 24 Aralık 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 27 Haziran 2012.
- ^ a b Cook, Melvin A. (1974). The Science of Industrial Explosives. IRECO Chemicals. s. 1. ASIN B0000EGDJT.
- ^ Brook, Tom Vanden. "Afghan bomb makers shifting to new explosives for IEDs". USA TODAY. 26 Haziran 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ US 5531941
- ^ Airbag Compound Has Vexed Takata for Years 26 Mayıs 2019 tarihinde Wayback Machine sitesinde arşivlendi. – The New York Times
- ^ A Cheaper Airbag, and Takata's Road to a Deadly Crisis. 10 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi. – The New York Times
- ^ a b c d Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate 26 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi. United States Environmental Protection Agency
- ^ "Storing and handling ammonium nitrate" (PDF). 4 Temmuz 2011 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Mart 2006.
- ^ "Ammonium nitrate MSDS". 18 Ağustos 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ Pradyot Patnaik (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ "Ammonium nitrate". PubChem. 13 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2020.
- ^ a b "Report for Kooragang Island Update PHA MOD1 Report". Orica Mining Services. 1 Nisan 2012. 12 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2020.
- ^ "Chemical Engineering Transactions" (PDF). 14 Nisan 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ "Ammonium Nitrate". webwiser.nlm.nih.gov (İngilizce). 22 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2020.
- ^ Fertilizers Europe (2006). "Guidance for Compatibility of Fertilizer Blending Materials" (PDF). 8 Haziran 2015 tarihinde kaynağından (PDF) arşivlendi.
- ^ "Dangerous Goods (HCDG) Regulations" (PDF). 23 Mart 2012 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 19 Ağustos 2020.
- ^ Ammonium Nitrate-Regulating its use, Balancing Access & Protection from "Worksafe Victoria". 11 Mart 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ a b CF Industries. "Amonyum nitrat MSDS" (PDF). 27 Mart 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ "Chemicalland21 – Amonyum Nitrat". 10 Ocak 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ "Amonyum Nitrat". Paton Fertilizers Pty Ltd. 2005.
- ^ "Malzeme Güvenlik Bilgi Formu, Amonyum nitrat MSDS". 18 Ağustos 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2020.
- ^ Chaturvedi, Shalini; Dave, Pragnesh N. (Ocak 2013). "Review on Thermal Decomposition of Ammonium Nitrate". Journal of Energetic Materials. 31 (1). ss. 1-26. doi:10.1080/07370652.2011.573523.
- ^ "Lübnan Cumhurbaşkanı, patlamadan sonra Beyrut'ta iki haftalık olağanüstü hal çağrısında bulundu" (İngilizce). Beyrut. Reuters. 4 Ağustos 2020. 5 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Ağustos 2020.
Aoun, Cumhurbaşkanlığı Twitter hesabından yaptığı açıklamada, 2.750 ton amonyum nitratın altı yıl boyunca güvenlik önlemleri alınmadan bir depoda saklanmasının "kabul edilemez" olduğunu belirterek, sorumluların "en ağır cezalarla karşılaşacaklarına" söz verdi.
Kaynaklar
değiştir- Özellikler: UNIDO ve Uluslararası Gübre Geliştirme Merkezi (1998), Gübre El Kitabı, Kluwer Academic Publishers, 0-7923-5032-4.
Dış bağlantılar
değiştir- Uluslararası Kimyasal Güvenlik Kartı 0216
- "Amonyum Nitratın Depolanması ve Kullanılması"4 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi., Birleşik Krallık Health and Safety Executive yayını INDG230 (1986)
- Kimyasal Danışmanlık: Amonyum Nitrat'ın Güvenli Depolanması, Kullanımı ve Yönetimi26 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi. Amerika Birleşik Devletleri Çevre Koruma Ajansı
- Hesaplayıcılar: amonyum nitrat sulu çözeltisinin yüzey gerilimleri22 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi. ile yoğunlukları, molarite ve molaliteleri22 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi.
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||
